元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:(1)元素C的最高价氧化物的电子式为;元素G的离子结构示意图为.(2)元素L位于周期表的第族,1mol/L LM2溶液500ml与0.4mol K单质恰好完全反应的离子方程式为.(3)化合物X是由B、E、G三种元素组成,其水溶液呈性,原因是(用离子方程式表示).(4)D和G组成的化合物GD,被大量用于制造电子元件.工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单
2019-04-20
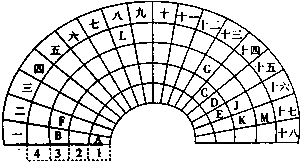 元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
(1)元素C的最高价氧化物的电子式为______;元素G的离子结构示意图为______.
(2)元素L位于周期表的第______族,1mol/L LM2溶液500ml与0.4mol K单质恰好完全反应的离子方程式为______.
(3)化合物X是由B、E、G三种元素组成,其水溶液呈______性,原因是______(用离子方程式表示).
(4)D和G组成的化合物GD,被大量用于制造电子元件.工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的物质的量之比为1:3,则该反应的化学方程式为.
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______.
优质解答
根据图片知,阿拉伯数字表示周期数,大写数字表示周期表的列,根据元素在周期表中的位置知,A、B、C、D、E、F、G、J、K、L、M分别是H、Na、C、N、O、Mg、Al、S、Cl、Fe、Br元素,
(1)素C是C元素,碳元素的最高价氧化物是二氧化碳,二氧化碳的电子式为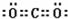 ,G是Al元素,铝离子核外有2个电子层,最外层有8个电子,其离子结构示意图为
,G是Al元素,铝离子核外有2个电子层,最外层有8个电子,其离子结构示意图为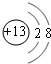 ,故答案为:
,故答案为: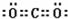 ;
; ;
;
(2)元素L为Fe元素,位于周期表的第VIII族,溴离子还原性小于亚铁离子,所以氯气先氧化亚铁后氧化溴离子,n(FeBr2)=1mol/L×0.5L=0.5mol,Fe 2+完全被氧化需要n(Cl2)为0.25mol,Br-完全被氧化需要n(Cl2)为0.5mol,所以FeBr2完全被氧化需要n(Cl2)为0.75mol>0.4mol,所以只有部分溴离子被氧化,被氧化的n(Br-)==0.3mol,所以被氧化的Fe 2+、Br-与参加反应的Cl2物质的量之比为0.5mol:0.3mol:0.4mol=5:3:4,所以其离子方程式为:10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl-,
故答案为:VIII;10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl-;
(3)化合物X是由Na、O、Al三种元素组成,则X是NaAlO2,偏铝酸钠是强碱弱酸盐,偏铝酸根离子水解而使其溶液呈碱性,水解离子方程式为AlO2-+2H2O⇌Al(OH)3+OH-,
故答案为:碱性;AlO2-+2H2O⇌Al(OH)3+OH-;
(4)N和Al组成的化合物AlN,G的氧化物是Al2O3,C单质是C,D的单质在N2,高温条件下,碳、氮气和氧化铝反应生成AlN,且Al2O3和C单质的物质的量之比为1:3,根据元素守恒知,另一种生成物是一氧化碳,结合原子守恒得反应方程式为Al2O3+3C+N22AlN+3CO,故答案为:Al2O3+3C+N22AlN+3CO;
(5)隔绝空气时SiO和NaOH溶液反应硅酸钠,根据元素守恒及转移电子守恒知,另一种生成物是氢气,反应方程式为SiO+2NaOH=Na2SiO3+H2↑,故答案为:SiO+2NaOH=Na2SiO3+H2↑.
根据图片知,阿拉伯数字表示周期数,大写数字表示周期表的列,根据元素在周期表中的位置知,A、B、C、D、E、F、G、J、K、L、M分别是H、Na、C、N、O、Mg、Al、S、Cl、Fe、Br元素,
(1)素C是C元素,碳元素的最高价氧化物是二氧化碳,二氧化碳的电子式为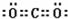 ,G是Al元素,铝离子核外有2个电子层,最外层有8个电子,其离子结构示意图为
,G是Al元素,铝离子核外有2个电子层,最外层有8个电子,其离子结构示意图为 ,故答案为:
,故答案为: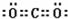 ;
; ;
;
(2)元素L为Fe元素,位于周期表的第VIII族,溴离子还原性小于亚铁离子,所以氯气先氧化亚铁后氧化溴离子,n(FeBr2)=1mol/L×0.5L=0.5mol,Fe 2+完全被氧化需要n(Cl2)为0.25mol,Br-完全被氧化需要n(Cl2)为0.5mol,所以FeBr2完全被氧化需要n(Cl2)为0.75mol>0.4mol,所以只有部分溴离子被氧化,被氧化的n(Br-)==0.3mol,所以被氧化的Fe 2+、Br-与参加反应的Cl2物质的量之比为0.5mol:0.3mol:0.4mol=5:3:4,所以其离子方程式为:10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl-,
故答案为:VIII;10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl-;
(3)化合物X是由Na、O、Al三种元素组成,则X是NaAlO2,偏铝酸钠是强碱弱酸盐,偏铝酸根离子水解而使其溶液呈碱性,水解离子方程式为AlO2-+2H2O⇌Al(OH)3+OH-,
故答案为:碱性;AlO2-+2H2O⇌Al(OH)3+OH-;
(4)N和Al组成的化合物AlN,G的氧化物是Al2O3,C单质是C,D的单质在N2,高温条件下,碳、氮气和氧化铝反应生成AlN,且Al2O3和C单质的物质的量之比为1:3,根据元素守恒知,另一种生成物是一氧化碳,结合原子守恒得反应方程式为Al2O3+3C+N22AlN+3CO,故答案为:Al2O3+3C+N22AlN+3CO;
(5)隔绝空气时SiO和NaOH溶液反应硅酸钠,根据元素守恒及转移电子守恒知,另一种生成物是氢气,反应方程式为SiO+2NaOH=Na2SiO3+H2↑,故答案为:SiO+2NaOH=Na2SiO3+H2↑.
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题: 元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题: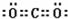 ,G是Al元素,铝离子核外有2个电子层,最外层有8个电子,其离子结构示意图为
,G是Al元素,铝离子核外有2个电子层,最外层有8个电子,其离子结构示意图为 ,故答案为:
,故答案为: