高纯氧化钙是用于电子工业的重要无机化工原料,用生石灰(主要成分为CaO)制备高纯氧化钙的工艺流程如下:请回答下列问题:(1)过滤操作中玻璃棒的作用是;(2)反应A的化学方程式为:;反应B的化学方程式为:;(3)过滤后所得沉淀表面可能含有的可溶性杂质有(写出一种化学式即可);洗涤的目的是为了.(4)灼烧时发生反应的化学方程式为,该工艺流程中可循环使用的物质是.(5)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙中会混有的两种杂质名称分别是和.
2019-11-27
高纯氧化钙是用于电子工业的重要无机化工原料,用生石灰(主要成分为CaO)制备高纯氧化钙的工艺流程如下:请回答下列问题:
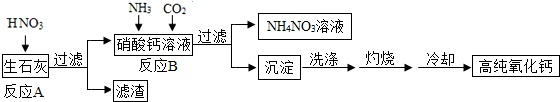
(1)过滤操作中玻璃棒的作用是___;
(2)反应A的化学方程式为:___;反应B的化学方程式为:___;
(3)过滤后所得沉淀表面可能含有的可溶性杂质有___(写出一种化学式即可);洗涤的目的是为了___.
(4)灼烧时发生反应的化学方程式为___,该工艺流程中可循环使用的物质是___.
(5)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙中会混有的两种杂质名称分别是___和___.
优质解答
(1)过滤操作中玻璃棒的作用是引流.故填:引流;
(2)根据图框中提示的反应物、生成物,可以书写反应A的化学方程式:2HNO3+CaO=Ca(NO3)2+H2O;反应B中发生反应的化学方程式为:CO2+2NH3•H2O+Ca(NO3)2═2NH4NO3+CaCO3↓+H2O;
(3)过滤后所得沉淀表面可能含有的可溶性杂质有硝酸钙、硝酸铵等;洗涤的目的是为了除掉沉淀表面的可溶性杂质;
(4)反应物是碳酸钙,生成物是氧化钙和二氧化碳,反应条件是高温,二氧化碳后面标上上升符号,所以化学方程式是:CaCO3CaO+CO2↑;因为碳酸钙受热分解能生成二氧化碳,二氧化碳在前边的反应中是反应物,所以该工艺流程中可循环使用的物质是二氧化碳;
(5)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙能和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水;故填:氢氧化钙;碳酸钙.
故答案为:
(1)引流;
(2)2HNO3+CaO=Ca(NO3)2+H2O;CO2+2NH3•H2O+Ca(NO3)2═2NH4NO3+CaCO3↓+H2O;
(3)Ca(NO3)2或NH4NO3;为了除掉沉淀表面的可溶性杂质;
(4)CaCO3CaO+CO2↑;二氧化碳;
(5)氢氧化钙;碳酸钙.
(1)过滤操作中玻璃棒的作用是引流.故填:引流;
(2)根据图框中提示的反应物、生成物,可以书写反应A的化学方程式:2HNO3+CaO=Ca(NO3)2+H2O;反应B中发生反应的化学方程式为:CO2+2NH3•H2O+Ca(NO3)2═2NH4NO3+CaCO3↓+H2O;
(3)过滤后所得沉淀表面可能含有的可溶性杂质有硝酸钙、硝酸铵等;洗涤的目的是为了除掉沉淀表面的可溶性杂质;
(4)反应物是碳酸钙,生成物是氧化钙和二氧化碳,反应条件是高温,二氧化碳后面标上上升符号,所以化学方程式是:CaCO3CaO+CO2↑;因为碳酸钙受热分解能生成二氧化碳,二氧化碳在前边的反应中是反应物,所以该工艺流程中可循环使用的物质是二氧化碳;
(5)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙能和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水;故填:氢氧化钙;碳酸钙.
故答案为:
(1)引流;
(2)2HNO3+CaO=Ca(NO3)2+H2O;CO2+2NH3•H2O+Ca(NO3)2═2NH4NO3+CaCO3↓+H2O;
(3)Ca(NO3)2或NH4NO3;为了除掉沉淀表面的可溶性杂质;
(4)CaCO3CaO+CO2↑;二氧化碳;
(5)氢氧化钙;碳酸钙.

