2019-11-27
下图是将SO2 转化为重要的化工原料H2SO4的原理示意图。
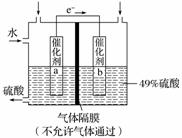
请回答下列问题:
(1)该装置将________能转化为________能,电流方向为________(填“b→a”或“a→b”)。
(2)催化剂b表面O2发生____________反应,其附近酸性________(填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_________________________________________。
(4)若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为________。