氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某化学研究小组利用制取氮化铝,设计图1验装置.试回答:(1)实验中用饱和NaNO2与NH4Cl溶液制取氮气的化学方程式为.(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是(填写序号).a.防止NaNO2 饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2 饱和溶液容易滴下(3)按图连接好实验装置,检查装置气密性的方法是.(4)化学研究小组的装置存在严重问题,请说
2019-04-14
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某化学研究小组利用制取氮化铝,设计图1验装置.试回答:
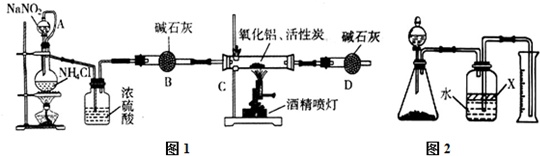
(1)实验中用饱和NaNO2与NH4Cl溶液制取氮气的化学方程式为___.
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是___(填写序号).
a.防止NaNO2 饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2 饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是___.
(4)化学研究小组的装置存在严重问题,请说明改进的办法___.
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气.
①氮化铝和NaOH溶液反应的化学方程式___.
②广口瓶中的试剂X最好选用___(填写序号).
a.汽油 b.酒精 c.植物油 d.CCl4
③广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将___(填“偏大”、“偏小”、“不变”).
④若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积为3.36L(标准状况),则样品中AlN的质量分数为___.
优质解答
制取氮化铝:用饱和NaNO2与NH4Cl溶液制取氮气NaNO2+NH4ClNaCl+N2↑+2H2O,装置中分液漏斗与蒸馏烧瓶之间的导管A,平衡内外压强,使NaNO2 饱和溶液容易滴下,制得的氮气排尽装置中的空气,碱石灰干燥氮气,氧化铝、碳和氮气在高温的条件下生成氮化铝和一氧化碳,方程式为:Al2O3+3C+N22AlN+3CO,D防止空气进入反应装置干扰实验.
(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水,反应为NaNO2+NH4ClNaCl+N2↑+2H2O,故答案为:NaNO2+NH4ClNaCl+N2↑+2H2O;
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A具有平衡气压的作用,这样可以保证NaNO2饱和溶液容易滴下,故选c;
(3)关闭分液漏斗开关,使装置处于密闭体系,将导管一端浸入水中,用手紧握锥形瓶外壁,由于热胀冷缩,锥形瓶内气体受热膨胀,如果导管口有气泡冒出,说明气密性良好,否则装置漏气,
故答案为:在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,证明气密性良好;
(4)实验必须对有毒气体进行尾气处理,应在干燥管D末端连接一个尾气处理装置,防止空气污染,
故答案为:在干燥管D末端连接一个尾气处理装置;
(5)①AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,根据元素守恒可知有水参加反应,其反应方程式为:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑,
故答案为:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑
②酒精、汽油虽然都不能与氨气发生反应,但它们却都极易挥发,挥发出来的气体对实验有影响而且挥发完后不能再起到隔离氨气与水接触的作用;同时由于酒精易溶于水,也不能达到隔离的目的;CCl4密度大于水,不能起到隔离作用,而植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离;
故答案为:C;
③本次实验的目的在于测定产生气体的体积而不是收集纯净的气体,因此,把最后空间中充入的氨气当成开始时的空气即可,不会对测量结果产生影响,
故答案为:不变;
④氨气的体积为3.36L(标准状况),物质的量是0.15mol,所以氮化铝的物质的量是0.15mol,质量是0.15mol×41g/mol=6.15g,所以氮化铝的质量分数为
×100%=61.5%,
故答案为:61.5%.
制取氮化铝:用饱和NaNO2与NH4Cl溶液制取氮气NaNO2+NH4ClNaCl+N2↑+2H2O,装置中分液漏斗与蒸馏烧瓶之间的导管A,平衡内外压强,使NaNO2 饱和溶液容易滴下,制得的氮气排尽装置中的空气,碱石灰干燥氮气,氧化铝、碳和氮气在高温的条件下生成氮化铝和一氧化碳,方程式为:Al2O3+3C+N22AlN+3CO,D防止空气进入反应装置干扰实验.
(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水,反应为NaNO2+NH4ClNaCl+N2↑+2H2O,故答案为:NaNO2+NH4ClNaCl+N2↑+2H2O;
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A具有平衡气压的作用,这样可以保证NaNO2饱和溶液容易滴下,故选c;
(3)关闭分液漏斗开关,使装置处于密闭体系,将导管一端浸入水中,用手紧握锥形瓶外壁,由于热胀冷缩,锥形瓶内气体受热膨胀,如果导管口有气泡冒出,说明气密性良好,否则装置漏气,
故答案为:在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,证明气密性良好;
(4)实验必须对有毒气体进行尾气处理,应在干燥管D末端连接一个尾气处理装置,防止空气污染,
故答案为:在干燥管D末端连接一个尾气处理装置;
(5)①AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,根据元素守恒可知有水参加反应,其反应方程式为:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑,
故答案为:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑
②酒精、汽油虽然都不能与氨气发生反应,但它们却都极易挥发,挥发出来的气体对实验有影响而且挥发完后不能再起到隔离氨气与水接触的作用;同时由于酒精易溶于水,也不能达到隔离的目的;CCl4密度大于水,不能起到隔离作用,而植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离;
故答案为:C;
③本次实验的目的在于测定产生气体的体积而不是收集纯净的气体,因此,把最后空间中充入的氨气当成开始时的空气即可,不会对测量结果产生影响,
故答案为:不变;
④氨气的体积为3.36L(标准状况),物质的量是0.15mol,所以氮化铝的物质的量是0.15mol,质量是0.15mol×41g/mol=6.15g,所以氮化铝的质量分数为
×100%=61.5%,
故答案为:61.5%.

