合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用. (1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2⇌2NH3.该可逆反应达到平衡的标志是;A.3v(H2)正=2v(NH3)逆B.单位时间生成mmolN2的同时生成3mmolH2C.容器内的总压强不再随时间而变化D.混合气体的密度不再随时间变化(2)氨气具有还原性,例如,氨气能与卤素单质发生置换反应.已知几种化学键的键能数据如表所示:请写出氨气与溴蒸汽反应的热化学方程式; 化学键
2019-11-27
合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2⇌2NH3.该可逆反应达到平衡的标志是___;
A.3v(H2)正=2v(NH3)逆
B.单位时间生成mmolN2的同时生成3mmolH2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)氨气具有还原性,例如,氨气能与卤素单质发生置换反应.已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸汽反应的热化学方程式___;
(3)工业上可用天然气为原料来制取合成氨的原料气氢气.某研究性学习小组的同学模拟工业制取氨气的原理,在一定温度下,体积为2L的恒容密闭容器中,测得如下表所示数据.请回答下列问题:
①分析标准数据,判断5min时反应是否处于平衡状态(填“是”或“否”),前5min反应的平均反应速率v(CH4)=___;
②该温度下,上述反应的平衡常数K=___;
③反应在7-10min内,CO的物质的量减少的原因可能是___(填字母)
A.减少CH4的物质的量 B.降低温度 C.升高温度 D.充入H2
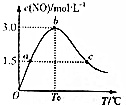
(4)氨的催化氧化:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)是工业制硝酸的重要反应.在1L密闭容器中充入4molNH3(g)和5molO2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示.该反应的△H___0(填“>”、“<”
或“=”);T0温度下,NH3的转化率为___.

(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2⇌2NH3.该可逆反应达到平衡的标志是___;
A.3v(H2)正=2v(NH3)逆
B.单位时间生成mmolN2的同时生成3mmolH2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)氨气具有还原性,例如,氨气能与卤素单质发生置换反应.已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸汽反应的热化学方程式___;
| 化学键 | N-H | N≡N | Br-Br | H-Br |
| 键能/kJ•mol-1 | 391 | 946 | 194 | 366 |
| 时间/min | CH4(mol) | H2O(mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
②该温度下,上述反应的平衡常数K=___;
③反应在7-10min内,CO的物质的量减少的原因可能是___(填字母)
A.减少CH4的物质的量 B.降低温度 C.升高温度 D.充入H2
(4)氨的催化氧化:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)是工业制硝酸的重要反应.在1L密闭容器中充入4molNH3(g)和5molO2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示.该反应的△H___0(填“>”、“<”
或“=”);T0温度下,NH3的转化率为___.