NH3是一种重要的化工原料,可用来制备肼、硝酸、硝酸铵和氯胺等.(1)N2和H2以物质的量之比为1:3在不同温度和压强下发生反应:N2+3H2⇌2NH3,测得平衡体系中NH3的物质的量分数如图1.①下列途径可提高氨气产率的是(填字母).a.采用常温条件b.采用适当的催化剂c.将原料气加压d.将氨液化,不断移去液氨②如图1中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1(填“>”“<”或“=”)K2.(2)肼(N2H4)是一种火箭燃料.已
2019-11-27
NH3是一种重要的化工原料,可用来制备肼、硝酸、硝酸铵和氯胺等.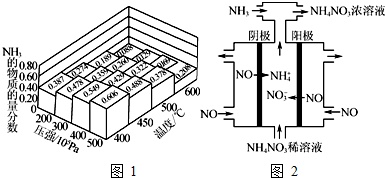
(1)N2和H2以物质的量之比为1:3在不同温度和压强下发生反应:N2+3H2⇌2NH3,测得平衡体系中NH3的物质的量分数如图1.
①下列途径可提高氨气产率的是___(填字母).
a.采用常温条件
b.采用适当的催化剂
c.将原料气加压
d.将氨液化,不断移去液氨
②如图1中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1___(填“>”“<”或“=”)K2.
(2)肼(N2H4)是一种火箭燃料.已知:
N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534.0kJ•mol-1
NO2(g)═
N2O4(g);△H=-28.0kJ•mol-1
①反应2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)的△H=___kJ•mol-1.
②氨气与次氯酸钠溶液反应生成肼的离子方程式为___.
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图2.
①阴极的电极反应式为___.
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为___.
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果,其原因是___.

(1)N2和H2以物质的量之比为1:3在不同温度和压强下发生反应:N2+3H2⇌2NH3,测得平衡体系中NH3的物质的量分数如图1.
①下列途径可提高氨气产率的是___(填字母).
a.采用常温条件
b.采用适当的催化剂
c.将原料气加压
d.将氨液化,不断移去液氨
②如图1中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1___(填“>”“<”或“=”)K2.
(2)肼(N2H4)是一种火箭燃料.已知:
N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534.0kJ•mol-1
NO2(g)═
| 1 |
| 2 |
①反应2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)的△H=___kJ•mol-1.
②氨气与次氯酸钠溶液反应生成肼的离子方程式为___.
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图2.
①阴极的电极反应式为___.
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为___.
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果,其原因是___.