我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题: (1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是;钾元素在周期表中的位置为.(2)上述元素中,简单离子组成与氩原子相同,且离子半径最大的元素,其原子核外有种不同能级的电子;已知其氧化物对应水化物能与氯单质反应,写出该水化物的电离方程式.(3)反应生成物中,属于非电解质的是(写化学式);写出熔点最高的物质的电子式.(4)上述元素中属于同周期元素的非金属性
2019-11-27
我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:
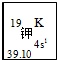
(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是___;钾元素在周期表中的位置为___.
(2)上述元素中,简单离子组成与氩原子相同,且离子半径最大的元素,其原子核外有___种不同能级的电子;已知其氧化物对应水化物能与氯单质反应,写出该水化物的电离方程式___.
(3)反应生成物中,属于非电解质的是___(写化学式);写出熔点最高的物质的电子式___.
(4)上述元素中属于同周期元素的非金属性由强到弱的顺序为___,从原子结构角度分析原因___.

(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是___;钾元素在周期表中的位置为___.
(2)上述元素中,简单离子组成与氩原子相同,且离子半径最大的元素,其原子核外有___种不同能级的电子;已知其氧化物对应水化物能与氯单质反应,写出该水化物的电离方程式___.
(3)反应生成物中,属于非电解质的是___(写化学式);写出熔点最高的物质的电子式___.
(4)上述元素中属于同周期元素的非金属性由强到弱的顺序为___,从原子结构角度分析原因___.
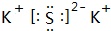 ,故答案为:CO2;
,故答案为:CO2;