氯气是一种重要的工业原料.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 △ . 2CaSO4+2Cl2↑+2H2O他们利用该反应设计如下制取氯气并验证其性质的实验.回答下列问题:(1)每生成1mol Cl2,上述化学反应转移电子数目为.(2)该实验中A部分的装置是 (填标号).(3)装置B中发生反应的离子方程式.(4)装置C中的现象为.(5)写出D装置中发生总反应的离子方程式.(6)该实验存在明显的缺陷,请你提出改进的方法.
2019-12-02
氯气是一种重要的工业原料.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验.
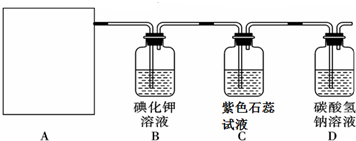
回答下列问题:
(1)每生成1mol Cl2,上述化学反应转移电子数目为___.
(2)该实验中A部分的装置是___ (填标号).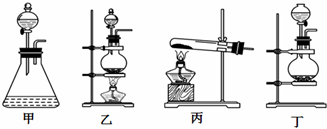
(3)装置B中发生反应的离子方程式___.
(4)装置C中的现象为___.
(5)写出D装置中发生总反应的离子方程式___.
(6)该实验存在明显的缺陷,请你提出改进的方法___.
| ||
他们利用该反应设计如下制取氯气并验证其性质的实验.

回答下列问题:
(1)每生成1mol Cl2,上述化学反应转移电子数目为___.
(2)该实验中A部分的装置是___ (填标号).

(3)装置B中发生反应的离子方程式___.
(4)装置C中的现象为___.
(5)写出D装置中发生总反应的离子方程式___.
(6)该实验存在明显的缺陷,请你提出改进的方法___.