氰化钠(NaCN)是一种重要的化工原料,用于化学合成、电镀、冶金等方面.(1)电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密,电解液使用Na[Ag(CN)2],请写出电解时阴极的电极反应式;已知:Na[Ag(CN)2]•(aq)⇌Ag•(aq)+2CN•(aq)K⇌1.3×10-21,请解释工业电镀中使用氰离子(CN+)的原因.(2)NaCN有剧毒,含氰废水需经无害化处理后才能排放,某电镀厂含氰废水的一种工业处理流程如下:已知:BCNO的结构式是:H-O-C≡N;氢氰酸是一种无色、剧
2019-11-27
氰化钠(NaCN)是一种重要的化工原料,用于化学合成、电镀、冶金等方面.
(1)电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密,电解液使用Na[Ag(CN)2],请写出电解时阴极的电极反应式___;已知:Na[Ag(CN)2]•(aq)⇌Ag•(aq)+2CN•(aq)K⇌1.3×10-21,请解释工业电镀中使用氰离子(CN+)的原因___.
(2)NaCN有剧毒,含氰废水需经无害化处理后才能排放,某电镀厂含氰废水的一种工业处理流程如下:
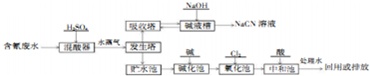
已知:BCNO的结构式是:H-O-C≡N;
氢氰酸是一种无色、剧毒、有挥发性的弱酸.
回答下列问题:
①CN+中两原子均为8电子稳定结构,请写出CN-的电子式___;
②氰化钠遇水会产生剧毒氢氰酸,请写出相应的离子方程式___.
③氧化池中氰化物的降解分两步进行,第一步:CN+被氯气氧化池低毒的CNO-,相应的离子方程式为:CN+Cl2+2OH-═CNO-+2Cl-+H2O;
第二步:CNO-被过滤氯气氧化成无毒的两种气体,写出相应的离子方程式___.
④贮水池中废水须先经碱化后再进行氧化的原因___.
(1)电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密,电解液使用Na[Ag(CN)2],请写出电解时阴极的电极反应式___;已知:Na[Ag(CN)2]•(aq)⇌Ag•(aq)+2CN•(aq)K⇌1.3×10-21,请解释工业电镀中使用氰离子(CN+)的原因___.
(2)NaCN有剧毒,含氰废水需经无害化处理后才能排放,某电镀厂含氰废水的一种工业处理流程如下:

已知:BCNO的结构式是:H-O-C≡N;
氢氰酸是一种无色、剧毒、有挥发性的弱酸.
回答下列问题:
①CN+中两原子均为8电子稳定结构,请写出CN-的电子式___;
②氰化钠遇水会产生剧毒氢氰酸,请写出相应的离子方程式___.
③氧化池中氰化物的降解分两步进行,第一步:CN+被氯气氧化池低毒的CNO-,相应的离子方程式为:CN+Cl2+2OH-═CNO-+2Cl-+H2O;
第二步:CNO-被过滤氯气氧化成无毒的两种气体,写出相应的离子方程式___.
④贮水池中废水须先经碱化后再进行氧化的原因___.
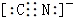 ,
,