(2013•淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.(1)粗盐精制就是除去其中的Ca2+、Fe3+、SO42-及泥沙等杂质,需加入的试剂有:①Na2CO3溶液 ②HCl(盐酸) ③Ba(OH)2溶液,这三种试剂的添加顺序是(填序号).(2)用氯气进行“海水提溴”中制取溴单质反应的离子方程式为:.(3)某同学设计了如图装置进行以下电化学实验.①当开关K与a连接时,两极均有气泡产生,则阴极为极.②一段时间后,使开关K与a断开、与b连接时,虚线框
 (2013•淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.
(2013•淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.
(1)粗盐精制就是除去其中的Ca2+、Fe3+、SO42-及泥沙等杂质,需加入的试剂有:
①Na2CO3溶液
②HCl(盐酸)
③Ba(OH)2溶液,这三种试剂的添加顺序是______(填序号).
(2)用氯气进行“海水提溴”中制取溴单质反应的离子方程式为:______.
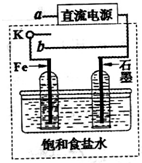
(3)某同学设计了如图装置进行以下电化学实验.
①当开关K与a连接时,两极均有气泡产生,则阴极为______极.
②一段时间后,使开关K与a断开、与b连接时,虚线框内的装置可称为______.请写出此时Fe电极上的电极反应式______.
(4)某公厂向盛有CaSO4悬浊液的反应池中通入氨气欲制取氮肥(NH4)2SO4,效果不好.再通入CO2,则逐渐产生大量(NH4)2SO4.请分析其原因[已知常温下:Ksp(CaSO4)=3.2×10-5,Ksp(CaCO3)=2.8×10-9].
2019-04-29
 (2013•淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.
(2013•淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.(1)粗盐精制就是除去其中的Ca2+、Fe3+、SO42-及泥沙等杂质,需加入的试剂有:
①Na2CO3溶液
②HCl(盐酸)
③Ba(OH)2溶液,这三种试剂的添加顺序是______(填序号).
(2)用氯气进行“海水提溴”中制取溴单质反应的离子方程式为:______.
(3)某同学设计了如图装置进行以下电化学实验.
①当开关K与a连接时,两极均有气泡产生,则阴极为______极.
②一段时间后,使开关K与a断开、与b连接时,虚线框内的装置可称为______.请写出此时Fe电极上的电极反应式______.
(4)某公厂向盛有CaSO4悬浊液的反应池中通入氨气欲制取氮肥(NH4)2SO4,效果不好.再通入CO2,则逐渐产生大量(NH4)2SO4.请分析其原因[已知常温下:Ksp(CaSO4)=3.2×10-5,Ksp(CaCO3)=2.8×10-9].