2020-02-03
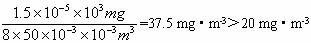
一、实验原理
2![]() +5HCHO+6H +
+5HCHO+6H + ![]() 2Mn 2+ +8H 2 O+5CO↑
2Mn 2+ +8H 2 O+5CO↑
二、测定装置
三、实验方法
①KMnO 4 标准液配制
准确称取1.58 g高锰酸钾,用少量水溶解,转入1000 mL容量瓶中,定容1000 mL,取此溶液1 mL,稀释到100倍,即得到1×10 -4 mol·L -1 的高锰酸钾溶液,保存备用。
②用2.5 mL注射器准确移取2 mL 1×10 -4 mol·L -1 的KMnO 4 溶液,注入六孔井穴板1 # 孔穴内,加3滴6 mol·L -1 H 2 SO 4 溶液,盖好盖子,按图连接好装置。将此装置置于待测地点,每次抽气50 mL,记录抽气次数。
试回答:
(1)该实验原理类似于中学化学的___________原理。
(2)当溶液由___________色变为___________色时即可停止抽气。
(3)抽气时应如何操作___________,否则将会使测定结果___________(填“偏低”“偏高”或“无影响”)。
(4)国家规定室内空气中甲醛气体的最高允许浓度为20 mg·m -3 ,若实验时抽气8次即达到反应终点,则该居室内甲醛是否超标___________(填“是”或“否”)。