(2014届山东省济南市高三3月模拟考试理综化学试卷)氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题:(1)氯碱工业是利用电解食盐水生产 为基础的工业体系。(2)电解前,为除去食盐水中的Mg 2+ 、Ca 2+ 、SO 4 2- 等杂质离子,加入下列试剂的顺序合理的是 (填下列各项中序号)。a
2019-11-23
| (2014届山东省济南市高三3月模拟考试理综化学试卷) 氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题: (1)氯碱工业是利用电解食盐水生产 为基础的工业体系。 (2)电解前,为除去食盐水中的Mg 2+ 、Ca 2+ 、SO 4 2- 等杂质离子,加入下列试剂的顺序合理的是 (填下列各项中序号)。 a、碳酸钠、氢氧化钠、氯化钡 b、碳酸钠、氯化钡、氢氧化钠 c、氢氧化钠、碳酸钠、氯化钡 d、氯化钡、氢氧化钠、碳酸钠 (3)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
利用盐泥生产MgSO 4 ·7H 2 O晶体的工艺流程如下图所示。 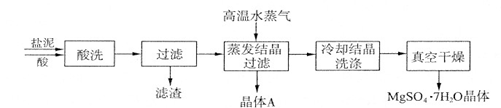 回答下列问题: ①酸洗过程中加入的酸为 ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH) 2 充分溶解并转化为MgSO 4 ,在此过程中同时生成CaSO 4 。其中碳酸钙可以转化为硫酸钙的原因是 。 ②过滤所得滤渣的主要成分为 。 ③根据图分析,蒸发结晶过滤所得晶体A主要成分为 。 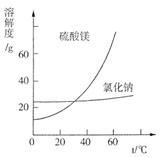 ④真空干燥MgSO 4 ·7H 2 O晶体的原因是 。 |