优质解答
常见气体制备
1.实验室制取气体的一般原则
(1)安全:避免和防止爆炸、燃烧、有毒物质外泄.
(2)方便:应用常用试剂、装置简单、操作方便.
(3)快速:反应时间不宜过长,过于剧烈的反应不安全,以反应速率适中为宜.
(4)生成物纯净(或虽含杂质但较易提纯),减少分离操作.
2.实验室制取气体的反应
(1)制取单质:用氧化还原反应.
(2)制取化合物:通常用复分解反应,如HCl、SO2、CO2、NH3、HNO3等;有时也可用氧化还原反应,如制NO2、NO等.
3.实验装置的安装、选择及操作步骤
(1)实验装置的安装顺序可用如下图表示:
(2)制取气体时各部分装置的选择依据:
①发生装置:所用试剂的状态及反应条件;
②收集装置:气体的水溶性及相对空气的密度大小、是否与空气中成分反应;
③净化装置:依据气体与杂质的性质的不同,使杂质被吸收或转化成所需物质;
④尾气处理(吸收)装置:根据所制气体是否有毒或污染环境来确定是否要安装尾气处理装置.有毒物质可用溶液吸收或燃烧去除.
(3)“气密性检查”在整个实验中的位置一般放在第二位,一般在装置连接好后、但在反应开始前检验气密性,决不可在药品混合并开始反应后检查气密性.
4.实验室制取气体的典型装置
主要掌握实验室三种不同类型制备气体的装置,以及三种不同类型的气体收集方法.根据气体的性质选择合适的干燥、净化和吸收装置.
实验室常用的三种不同类型制备气体的装置:
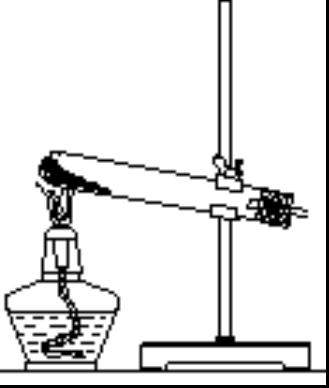
(1)固体——固体加热装置(见图)
所需仪器:铁架台、铁夹、酒精灯、大试管、单孔橡胶塞、导气管等.常用于制O2、NH3、CH4等.
注意事项:
①试管口应稍向下倾斜,以防止产生的水蒸气在管口冷凝后倒流而引起试管破裂.
②铁夹应夹在距试管口1/3处.
③固体药品要在试管底部平铺开.加热时首先均匀预热(移动酒精灯),然后在试管的药品最后部位集中加热,并逐步前移.
④胶塞上的导管伸入试管里面不能过长,否则会妨碍气体的导出.
⑤如用排水集气法收集气体,当停止制取气体时,应先从水槽中把导管撤出,然后再撤走酒精灯,以防水倒流.
(2)固体——液体(液体——液体)加热装置(见图)
所需仪器:铁架台、铁夹、烧瓶、分液漏斗、双孔塞、导管等.常用于制H2、CO2、H2S、NO2、SO2、NO等.
注意事项:
①烧瓶应固定在铁架台上.
②先把固体药品放入烧瓶中,然后再慢慢加入液体.
③分液漏斗内为挥发性液体时要盖上盖,注意盖上的小槽要对准分液漏斗颈上的小孔.
④制H2、CO2、H2S时也可用下面的装置.
这类装置使用方便,可以随时使反应发生或停止.
说明: ①在简易装置中长颈漏斗颈的下口应伸入液面以下,否则起不到液封作用而无法使用. ②加入的固体药品块状大小要适宜,如果太碎会落入底部的酸中使反应无法终止. ③加入酸的量要适当. ④最初使用时应待容器内原有的空气排净后,再收集气体. ⑤在导管口点燃氢气或其他可燃性气体时,必须先检验纯度.
5.气体发生装置气密性的检查
检验气密性时,可把导管一端浸入水里,用手掌紧贴烧瓶外壁,如果装置不漏气,烧瓶里的空气受热膨胀,导管口就会有气泡冒出.把手移开后,过一会儿烧瓶冷却,水就会上升到导管里,形成一段水柱(见下图I、Ⅱ).如果发现漏气,必须找出原因,并进行调整、修理或更换零件.
 常见气体制备
常见气体制备
1.实验室制取气体的一般原则
(1)安全:避免和防止爆炸、燃烧、有毒物质外泄.
(2)方便:应用常用试剂、装置简单、操作方便.
(3)快速:反应时间不宜过长,过于剧烈的反应不安全,以反应速率适中为宜.
(4)生成物纯净(或虽含杂质但较易提纯),减少分离操作.
2.实验室制取气体的反应
(1)制取单质:用氧化还原反应.
(2)制取化合物:通常用复分解反应,如HCl、SO2、CO2、NH3、HNO3等;有时也可用氧化还原反应,如制NO2、NO等.
3.实验装置的安装、选择及操作步骤
(1)实验装置的安装顺序可用如下图表示:
(2)制取气体时各部分装置的选择依据:
①发生装置:所用试剂的状态及反应条件;
②收集装置:气体的水溶性及相对空气的密度大小、是否与空气中成分反应;
③净化装置:依据气体与杂质的性质的不同,使杂质被吸收或转化成所需物质;
④尾气处理(吸收)装置:根据所制气体是否有毒或污染环境来确定是否要安装尾气处理装置.有毒物质可用溶液吸收或燃烧去除.
(3)“气密性检查”在整个实验中的位置一般放在第二位,一般在装置连接好后、但在反应开始前检验气密性,决不可在药品混合并开始反应后检查气密性.
4.实验室制取气体的典型装置
主要掌握实验室三种不同类型制备气体的装置,以及三种不同类型的气体收集方法.根据气体的性质选择合适的干燥、净化和吸收装置.
实验室常用的三种不同类型制备气体的装置:
(1)固体——固体加热装置(见图)
所需仪器:铁架台、铁夹、酒精灯、大试管、单孔橡胶塞、导气管等.常用于制O2、NH3、CH4等.
注意事项:
①试管口应稍向下倾斜,以防止产生的水蒸气在管口冷凝后倒流而引起试管破裂.
②铁夹应夹在距试管口1/3处.
③固体药品要在试管底部平铺开.加热时首先均匀预热(移动酒精灯),然后在试管的药品最后部位集中加热,并逐步前移.
④胶塞上的导管伸入试管里面不能过长,否则会妨碍气体的导出.
⑤如用排水集气法收集气体,当停止制取气体时,应先从水槽中把导管撤出,然后再撤走酒精灯,以防水倒流.
(2)固体——液体(液体——液体)加热装置(见图)
所需仪器:铁架台、铁夹、烧瓶、分液漏斗、双孔塞、导管等.常用于制H2、CO2、H2S、NO2、SO2、NO等.
注意事项:
①烧瓶应固定在铁架台上.
②先把固体药品放入烧瓶中,然后再慢慢加入液体.
③分液漏斗内为挥发性液体时要盖上盖,注意盖上的小槽要对准分液漏斗颈上的小孔.
④制H2、CO2、H2S时也可用下面的装置.
这类装置使用方便,可以随时使反应发生或停止.
说明: ①在简易装置中长颈漏斗颈的下口应伸入液面以下,否则起不到液封作用而无法使用. ②加入的固体药品块状大小要适宜,如果太碎会落入底部的酸中使反应无法终止. ③加入酸的量要适当. ④最初使用时应待容器内原有的空气排净后,再收集气体. ⑤在导管口点燃氢气或其他可燃性气体时,必须先检验纯度.
5.气体发生装置气密性的检查
检验气密性时,可把导管一端浸入水里,用手掌紧贴烧瓶外壁,如果装置不漏气,烧瓶里的空气受热膨胀,导管口就会有气泡冒出.把手移开后,过一会儿烧瓶冷却,水就会上升到导管里,形成一段水柱(见下图I、Ⅱ).如果发现漏气,必须找出原因,并进行调整、修理或更换零件.

1.实验室制取气体的一般原则
(1)安全:避免和防止爆炸、燃烧、有毒物质外泄.
(2)方便:应用常用试剂、装置简单、操作方便.
(3)快速:反应时间不宜过长,过于剧烈的反应不安全,以反应速率适中为宜.
(4)生成物纯净(或虽含杂质但较易提纯),减少分离操作.
2.实验室制取气体的反应
(1)制取单质:用氧化还原反应.
(2)制取化合物:通常用复分解反应,如HCl、SO2、CO2、NH3、HNO3等;有时也可用氧化还原反应,如制NO2、NO等.
3.实验装置的安装、选择及操作步骤
(1)实验装置的安装顺序可用如下图表示:
(2)制取气体时各部分装置的选择依据:
①发生装置:所用试剂的状态及反应条件;
②收集装置:气体的水溶性及相对空气的密度大小、是否与空气中成分反应;
③净化装置:依据气体与杂质的性质的不同,使杂质被吸收或转化成所需物质;
④尾气处理(吸收)装置:根据所制气体是否有毒或污染环境来确定是否要安装尾气处理装置.有毒物质可用溶液吸收或燃烧去除.
(3)“气密性检查”在整个实验中的位置一般放在第二位,一般在装置连接好后、但在反应开始前检验气密性,决不可在药品混合并开始反应后检查气密性.
4.实验室制取气体的典型装置
主要掌握实验室三种不同类型制备气体的装置,以及三种不同类型的气体收集方法.根据气体的性质选择合适的干燥、净化和吸收装置.
实验室常用的三种不同类型制备气体的装置:
(1)固体——固体加热装置(见图)
所需仪器:铁架台、铁夹、酒精灯、大试管、单孔橡胶塞、导气管等.常用于制O2、NH3、CH4等.
注意事项:
①试管口应稍向下倾斜,以防止产生的水蒸气在管口冷凝后倒流而引起试管破裂.
②铁夹应夹在距试管口1/3处.
③固体药品要在试管底部平铺开.加热时首先均匀预热(移动酒精灯),然后在试管的药品最后部位集中加热,并逐步前移.
④胶塞上的导管伸入试管里面不能过长,否则会妨碍气体的导出.
⑤如用排水集气法收集气体,当停止制取气体时,应先从水槽中把导管撤出,然后再撤走酒精灯,以防水倒流.
(2)固体——液体(液体——液体)加热装置(见图)
所需仪器:铁架台、铁夹、烧瓶、分液漏斗、双孔塞、导管等.常用于制H2、CO2、H2S、NO2、SO2、NO等.
注意事项:
①烧瓶应固定在铁架台上.
②先把固体药品放入烧瓶中,然后再慢慢加入液体.
③分液漏斗内为挥发性液体时要盖上盖,注意盖上的小槽要对准分液漏斗颈上的小孔.
④制H2、CO2、H2S时也可用下面的装置.
这类装置使用方便,可以随时使反应发生或停止.
说明: ①在简易装置中长颈漏斗颈的下口应伸入液面以下,否则起不到液封作用而无法使用. ②加入的固体药品块状大小要适宜,如果太碎会落入底部的酸中使反应无法终止. ③加入酸的量要适当. ④最初使用时应待容器内原有的空气排净后,再收集气体. ⑤在导管口点燃氢气或其他可燃性气体时,必须先检验纯度.
5.气体发生装置气密性的检查
检验气密性时,可把导管一端浸入水里,用手掌紧贴烧瓶外壁,如果装置不漏气,烧瓶里的空气受热膨胀,导管口就会有气泡冒出.把手移开后,过一会儿烧瓶冷却,水就会上升到导管里,形成一段水柱(见下图I、Ⅱ).如果发现漏气,必须找出原因,并进行调整、修理或更换零件.
 常见气体制备
常见气体制备1.实验室制取气体的一般原则
(1)安全:避免和防止爆炸、燃烧、有毒物质外泄.
(2)方便:应用常用试剂、装置简单、操作方便.
(3)快速:反应时间不宜过长,过于剧烈的反应不安全,以反应速率适中为宜.
(4)生成物纯净(或虽含杂质但较易提纯),减少分离操作.
2.实验室制取气体的反应
(1)制取单质:用氧化还原反应.
(2)制取化合物:通常用复分解反应,如HCl、SO2、CO2、NH3、HNO3等;有时也可用氧化还原反应,如制NO2、NO等.
3.实验装置的安装、选择及操作步骤
(1)实验装置的安装顺序可用如下图表示:
(2)制取气体时各部分装置的选择依据:
①发生装置:所用试剂的状态及反应条件;
②收集装置:气体的水溶性及相对空气的密度大小、是否与空气中成分反应;
③净化装置:依据气体与杂质的性质的不同,使杂质被吸收或转化成所需物质;
④尾气处理(吸收)装置:根据所制气体是否有毒或污染环境来确定是否要安装尾气处理装置.有毒物质可用溶液吸收或燃烧去除.
(3)“气密性检查”在整个实验中的位置一般放在第二位,一般在装置连接好后、但在反应开始前检验气密性,决不可在药品混合并开始反应后检查气密性.
4.实验室制取气体的典型装置
主要掌握实验室三种不同类型制备气体的装置,以及三种不同类型的气体收集方法.根据气体的性质选择合适的干燥、净化和吸收装置.
实验室常用的三种不同类型制备气体的装置:
(1)固体——固体加热装置(见图)
所需仪器:铁架台、铁夹、酒精灯、大试管、单孔橡胶塞、导气管等.常用于制O2、NH3、CH4等.
注意事项:
①试管口应稍向下倾斜,以防止产生的水蒸气在管口冷凝后倒流而引起试管破裂.
②铁夹应夹在距试管口1/3处.
③固体药品要在试管底部平铺开.加热时首先均匀预热(移动酒精灯),然后在试管的药品最后部位集中加热,并逐步前移.
④胶塞上的导管伸入试管里面不能过长,否则会妨碍气体的导出.
⑤如用排水集气法收集气体,当停止制取气体时,应先从水槽中把导管撤出,然后再撤走酒精灯,以防水倒流.
(2)固体——液体(液体——液体)加热装置(见图)
所需仪器:铁架台、铁夹、烧瓶、分液漏斗、双孔塞、导管等.常用于制H2、CO2、H2S、NO2、SO2、NO等.
注意事项:
①烧瓶应固定在铁架台上.
②先把固体药品放入烧瓶中,然后再慢慢加入液体.
③分液漏斗内为挥发性液体时要盖上盖,注意盖上的小槽要对准分液漏斗颈上的小孔.
④制H2、CO2、H2S时也可用下面的装置.
这类装置使用方便,可以随时使反应发生或停止.
说明: ①在简易装置中长颈漏斗颈的下口应伸入液面以下,否则起不到液封作用而无法使用. ②加入的固体药品块状大小要适宜,如果太碎会落入底部的酸中使反应无法终止. ③加入酸的量要适当. ④最初使用时应待容器内原有的空气排净后,再收集气体. ⑤在导管口点燃氢气或其他可燃性气体时,必须先检验纯度.
5.气体发生装置气密性的检查
检验气密性时,可把导管一端浸入水里,用手掌紧贴烧瓶外壁,如果装置不漏气,烧瓶里的空气受热膨胀,导管口就会有气泡冒出.把手移开后,过一会儿烧瓶冷却,水就会上升到导管里,形成一段水柱(见下图I、Ⅱ).如果发现漏气,必须找出原因,并进行调整、修理或更换零件.
