氯气是一种重要的化工原料。(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是。 (2)资料显示:Ca(ClO) 2 +CaCl 2 +2H 2 SO 4 2CaSO 4 +2Cl 2 ↑+2H 2 O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。 ①在该实验中,甲部分的装置是(填字母); ②丙装置中通入少量Cl 2 ,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是;③该实验存在
2019-04-04
| 氯气是一种重要的化工原料。 (1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是_______________________。 (2)资料显示:Ca(ClO) 2 +CaCl 2 +2H 2 SO 4  2CaSO 4 +2Cl 2 ↑+2H 2 O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。 2CaSO 4 +2Cl 2 ↑+2H 2 O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。 |
 |
| ①在该实验中,甲部分的装置是_______________(填字母); |
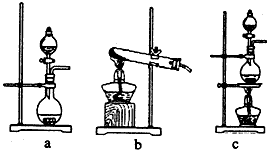 |
| ②丙装置中通入少量Cl 2 ,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是_______________________; ③该实验存在明显的缺陷,改进的方法是___________________________。 (3)为测定漂白粉中Ca(ClO) 2 的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H 2 SO 4 、过量KI溶液,完全反应后,再滴入0.1mol·L -1 Na 2 S 2 O 3 溶液: 2Na 2 S 2 O 3 +I 2 =Na 2 S 4 O 6 +2NaI,共消耗20mLNa 2 S 2 O 3 溶液,则漂白粉中Ca(ClO) 2 的质量分数为_________。 |
 MnCl 2 +Cl 2 ↑+2H 2 O
MnCl 2 +Cl 2 ↑+2H 2 O