同学们在学习了盐的化学性质以后,开展了测定碳酸钠和氯化钠的固体混合物中碳酸钠的质量分数的探究实验,他们设计了以下实验方案【方案一】气体转化法(1)如图1所示,把wg的混合物与足量稀硫酸反应后,测定产生的CO2的体积,检查该装置气密性的方法是;(2)有同学提出用图2代替图1中的收集装置,则所测得CO2气体的体积;(填偏大、偏小或不变)理由是,你的改进方案是;广口瓶内原有的空气对实验结果(填“有”或“没有”)影响,如果利用改进后的装置测得CO2气体的体积为VmL (此时CO2的密度为Pg/mL)则原
2019-06-27
同学们在学习了盐的化学性质以后,开展了测定碳酸钠和氯化钠的固体混合物中碳酸钠的质量分数的探究实验,他们设计了以下实验方案
【方案一】气体转化法
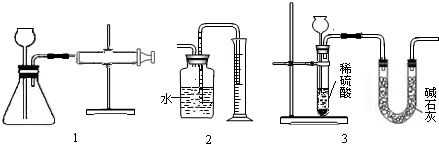
(1)如图1所示,把wg的混合物与足量稀硫酸反应后,测定产生的CO2的体积,检查该装置气密性的方法是______;
(2)有同学提出用图2代替图1中的收集装置,则所测得CO2气体的体积______;
(填偏大、偏小或不变)理由是______,你的改进方案是______;广口瓶内原有的空气对实验结果______(填“有”或“没有”)影响,如果利用改进后的装置测得CO2气体的体积为VmL (此时CO2的密度为Pg/mL)则原混合物中Na2CO3的质量分数的计算式为
×100%
×100%;
(3)也有人用图3装置测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物)则图3实验装置中主要存在哪些缺陷?这些缺陷对实验结果有何影响?
【方案二】沉淀法(如图所示)
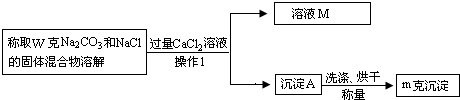
(1)沉淀A的化学式是______,溶液M中溶质的化学式是______;
(2)确定CaCl2溶液是否过量的方法是______;
(3)该固体混合物中Na2CO3的质量分数的计算式为
×100%
×100%;
(4)导致测定结果偏大的原因可能是______;
【方案三】盐酸滴定法

(1)“操作2”的名称是______;
(2)根据实验数据计算该固体混合物中Na2CO3的质量分数为______(保留一位小数).
【方案一】气体转化法

(1)如图1所示,把wg的混合物与足量稀硫酸反应后,测定产生的CO2的体积,检查该装置气密性的方法是______;
(2)有同学提出用图2代替图1中的收集装置,则所测得CO2气体的体积______;
(填偏大、偏小或不变)理由是______,你的改进方案是______;广口瓶内原有的空气对实验结果______(填“有”或“没有”)影响,如果利用改进后的装置测得CO2气体的体积为VmL (此时CO2的密度为Pg/mL)则原混合物中Na2CO3的质量分数的计算式为
| 106PV |
| 44W |
| 106PV |
| 44W |
(3)也有人用图3装置测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物)则图3实验装置中主要存在哪些缺陷?这些缺陷对实验结果有何影响?
| 主 要 缺 陷 | 对实验结果的影响 |

(1)沉淀A的化学式是______,溶液M中溶质的化学式是______;
(2)确定CaCl2溶液是否过量的方法是______;
(3)该固体混合物中Na2CO3的质量分数的计算式为
| 53m |
| 50w |
| 53m |
| 50w |
(4)导致测定结果偏大的原因可能是______;
【方案三】盐酸滴定法

(1)“操作2”的名称是______;
(2)根据实验数据计算该固体混合物中Na2CO3的质量分数为______(保留一位小数).