图一是煤化工产业链的一部分,试运用所学知识,回答下列问题:(1)图一中气体A的俗称是(2)合成氨工业是煤化工产业链中非常重要的一步.已知有一组数据:破坏1mol氮气中的化学键需要吸收946kJ能量;破坏0.5mol氢气中的H-H键需要吸收218kJ的能量;形成氨分子中1mol N-H键能够释放389kJ能量.图二表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值,填在下边的横线上.①kJ,②kJ(3)煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2
2019-04-20
图一是煤化工产业链的一部分,试运用所学知识,回答下列问题:
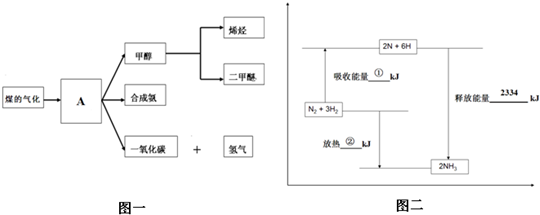
(1)图一中气体A的俗称是______
(2)合成氨工业是煤化工产业链中非常重要的一步.已知有一组数据:破坏1mol氮气中的化学键需要吸收946kJ能量;破坏0.5mol氢气中的H-H键需要吸收218kJ的能量;形成氨分子中1mol N-H键能够释放389kJ能量.图二表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值,填在下边的横线上.
①______kJ,②______kJ
(3)煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇,该反应的化学方程式为:CO (g)+2H2(g)⇌CH3OH(g)①下列描述中能说明上述反应已达平衡的是______;
A.容器内气体的平均摩尔质量保持不变
B.2v(H2)正=v(CH3OH)逆
C.容器中气体的压强保持不变
D.单位时间内生成n molCO的同时生成2n mol H2
②在容积固定的恒温密闭容器中充入CO和H2发生上述反应,反应在第4min时候达到其限度,此时容器中压强与反应前之比为3:5,容器内物质的各种物质的量浓度如下表:
则b=______
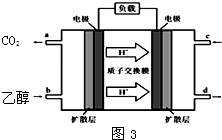
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如图3所示,该燃料电池的电池反应式为2CH3OH (g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为______,正极附近pH值______(填写“增大”、“减小”或者“不变”)

(1)图一中气体A的俗称是______
(2)合成氨工业是煤化工产业链中非常重要的一步.已知有一组数据:破坏1mol氮气中的化学键需要吸收946kJ能量;破坏0.5mol氢气中的H-H键需要吸收218kJ的能量;形成氨分子中1mol N-H键能够释放389kJ能量.图二表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值,填在下边的横线上.
①______kJ,②______kJ
(3)煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇,该反应的化学方程式为:CO (g)+2H2(g)⇌CH3OH(g)①下列描述中能说明上述反应已达平衡的是______;
A.容器内气体的平均摩尔质量保持不变
B.2v(H2)正=v(CH3OH)逆
C.容器中气体的压强保持不变
D.单位时间内生成n molCO的同时生成2n mol H2
②在容积固定的恒温密闭容器中充入CO和H2发生上述反应,反应在第4min时候达到其限度,此时容器中压强与反应前之比为3:5,容器内物质的各种物质的量浓度如下表:
| 时间/浓度 | c(CO)(mol/L) | c(H2 )(mol/L) | c(CH3OH)(mol/L) |
| 起始 | 0.200 | 0.300 | 0.000 |
| 第4min | a | b | c |
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如图3所示,该燃料电池的电池反应式为2CH3OH (g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为______,正极附近pH值______(填写“增大”、“减小”或者“不变”)
