如图所示为实验室常用的实验装置(1)写出下列仪器名称:a;b.(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是(填装置的字母代号),化学方程式是2KMnO4 △ . K2MnO4+MnO2+O2↑2KMnO4 △ . K2MnO4+MnO2+O2↑,用氯酸钾制取氧气的化学方程式为2KClO3MnO2.△2KCl+3O2↑2KClO3MnO2.△2KCl+3O2↑.(3)实验室用锌和稀硫酸反应制取
2019-04-20
如图所示为实验室常用的实验装置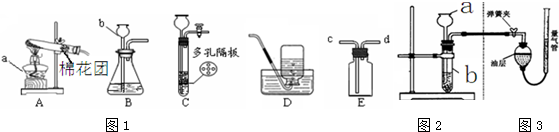
(1)写出下列仪器名称:a______;b______.
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是______(填装置的字母代号),化学方程式是
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是______,若用E装置收集氢气,应从______(填c或d)口通入氢气.
(4)装置C相对于装置B在操作方面的优势为______.
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
【拓展实验一】探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如表:
【拓展实验二】测定石头纸中碳酸钙的质量分数
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和.)将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.如图2为石头纸与稀盐酸反应的装置,图3用于测量CO2的体积.
①连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置2气密性______(选填“良好”或“漏气”)
②图3装置中油层的作用是______;
③反应停止后,______(填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.
A.水平移动量气管 B.上下移动量气管 C.封闭量气管
(7)乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如表.(其他物质既不溶于水也不跟酸反应)
通过对数据的分析和比较,回答下列有关问题:
①在第1份样品的实验中,______完全反应了.
②m为______
③石头纸样品中碳酸钙的质量分数是多少?

(1)写出下列仪器名称:a______;b______.
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是______(填装置的字母代号),化学方程式是
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,用氯酸钾制取氧气的化学方程式为
| ||
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
.
| ||
| △ |
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是______,若用E装置收集氢气,应从______(填c或d)口通入氢气.
(4)装置C相对于装置B在操作方面的优势为______.
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
【拓展实验一】探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如表:
| 甲 | 乙 | |
| 实验过程 | 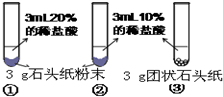 | 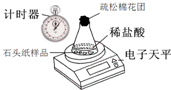 |
| 实验现象 | 试管①、②、③中产生气泡快慢的顺序为: ①>②>③. | |
| 分析结论 | Ⅰ碳酸钙与稀盐酸反应的化学方程式为______ Ⅱ对比甲同学实验①②可知,______,化学反应的速度越快; Ⅲ对比甲同学实验______(填实验序号)可知,反应物的接触面积越大,反应速率越______. Ⅳ乙同学的实验中,数据记录纸上应该连续记录的实验数据是______ 和______. | |
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和.)将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.如图2为石头纸与稀盐酸反应的装置,图3用于测量CO2的体积.
①连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置2气密性______(选填“良好”或“漏气”)
②图3装置中油层的作用是______;
③反应停止后,______(填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.
A.水平移动量气管 B.上下移动量气管 C.封闭量气管
(7)乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如表.(其他物质既不溶于水也不跟酸反应)
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |
①在第1份样品的实验中,______完全反应了.
②m为______
③石头纸样品中碳酸钙的质量分数是多少?