三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:I.制备POCl3采用氧气氧化液态的PCl3法,实验装置(加热及夹持装置省略)及相关信息如下: 物质 熔点/℃ 沸点/℃ 相对分子质量 其他 PCl3 -112.0 76.0 137.5 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 POCl3 2.0 106.0 153.5 (1)仪器a的名称为;(
2019-11-27
三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:
I.制备POCl3
采用氧气氧化液态的PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:
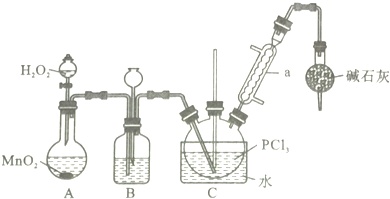
(1)仪器a的名称为___;
(2)装置C中生成POCl3的化学方程式为___;
(3)实验中需控制通入O2的速率,对此采取的操作是___;
(4)装置B的作用除观察O2的流速之外,还有___、___;
(5)反应温度应控制在60~65℃,原因是___;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液.
(6)达到终点时的现象是___;
(7)测得产品中n(POCl3)=___;
(8)已知Ksp(AgCl)>Ksp(AgSCN),据此判断,若取消步骤③,测定结果将___.(填偏高,偏低,或不变)
I.制备POCl3
采用氧气氧化液态的PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:

| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(2)装置C中生成POCl3的化学方程式为___;
(3)实验中需控制通入O2的速率,对此采取的操作是___;
(4)装置B的作用除观察O2的流速之外,还有___、___;
(5)反应温度应控制在60~65℃,原因是___;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液.
(6)达到终点时的现象是___;
(7)测得产品中n(POCl3)=___;
(8)已知Ksp(AgCl)>Ksp(AgSCN),据此判断,若取消步骤③,测定结果将___.(填偏高,偏低,或不变)