亚硝酰氯(NOCl)是有机合成中的重要试剂,可由一氧化氮与氯气在常温常压下合成.己知NOCl是一种红褐色液体或黄色气体,其 熔点是-64.5℃,沸点是-5.5℃,遇水易水解.(1)实验室制备原料气NO和Cl2的装置如1图所示.①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为②实验室制Cl2时,装置B中盛放的试剂为,其作用是(2)将上述收集到的Cl2充入集气瓶中,按图2示装置制备亚硝酰氯.①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为②装 置D中的现象为③装置E中无水氯化钙的作用为④
2019-06-24
亚硝酰氯(NOCl)是有机合成中的重要试剂,可由一氧化氮与氯气在常温常压下合成.己知NOCl是一种红褐色液体或黄色气体,其 熔点是-64.5℃,沸点是-5.5℃,遇水易水解.
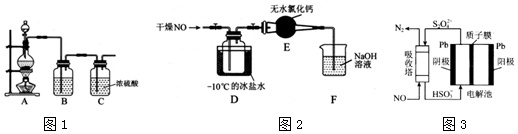
(1)实验室制备原料气NO和Cl2的装置如1图所示.
①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为___
②实验室制Cl2时,装置B中盛放的试剂为___,其作用是___
(2)将上述收集到的Cl2充入集气瓶中,按图2示装置制备亚硝酰氯.
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为___
②装 置D中的现象为___
③装置E中无水氯化钙的作用为___
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是___
(3)NO可用间接电化学法除去,其原理如图3所示.
①阴极的电极反应式为___
②吸收塔内发生反应的离子方程式为___.

(1)实验室制备原料气NO和Cl2的装置如1图所示.
①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为___
②实验室制Cl2时,装置B中盛放的试剂为___,其作用是___
(2)将上述收集到的Cl2充入集气瓶中,按图2示装置制备亚硝酰氯.
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为___
②装 置D中的现象为___
③装置E中无水氯化钙的作用为___
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是___
(3)NO可用间接电化学法除去,其原理如图3所示.
①阴极的电极反应式为___
②吸收塔内发生反应的离子方程式为___.
 ;
;