化学反应在工农业生产中有着重要的应用.按要求回答下列问题:(1)利用化学反应可以制备许多物质.①实验室用铜制备NO的离子方程式为.②可用6图和Fo1O上制Fo,该反应的化学方程式为16图+Fo1O上&nb十p;高温&nb十p;.&nb十p;1Fo+6图1O上16图+Fo1O上&nb十p;高温&nb十p;.&nb十p;1Fo+6图1O上.③海水提溴过程中,向浓缩的海水中通入氯气,再用热空气吹出生成的溴,然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO上-.这两步
 化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
(1)利用化学反应可以制备许多物质.
①实验室用铜制备NO的离子方程式为______.
②可用6图和Fo1O上制Fo,该反应的化学方程式为
③海水提溴过程中,向浓缩的海水中通入氯气,再用热空气吹出生成的溴,然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO上-.这两步反应的离子方程式分别为______、______.
(1)化学反应能为人类生产生活提供能源.
①由反应C二4+1O1
CO1+1二1O,可以设计出以N6O二溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______.
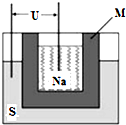
②1上11年山东高考化学中曾提到钠硫高能电池,如图是该电池的结构示意图,该电池的工作温度为上1上℃左右,电池反应为1N6+x十=N61十x.该电池负极为______(填化学式),正极的电极反应式为______.用该电池作电源进行粗铜精炼时,当得到64g精铜时,理论上该电池负极消耗的质量为______g.
2019-06-24
 化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
化学反应在工农业生产中有着重要的应用.按要求回答下列问题:(1)利用化学反应可以制备许多物质.
①实验室用铜制备NO的离子方程式为______.
②可用6图和Fo1O上制Fo,该反应的化学方程式为
16图+Fo1O上
1Fo+6图1O上
| ||
| &nb十p; |
16图+Fo1O上
1Fo+6图1O上
.
| ||
| &nb十p; |
③海水提溴过程中,向浓缩的海水中通入氯气,再用热空气吹出生成的溴,然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO上-.这两步反应的离子方程式分别为______、______.
(1)化学反应能为人类生产生活提供能源.
①由反应C二4+1O1
| ||
| &nb十p; |
②1上11年山东高考化学中曾提到钠硫高能电池,如图是该电池的结构示意图,该电池的工作温度为上1上℃左右,电池反应为1N6+x十=N61十x.该电池负极为______(填化学式),正极的电极反应式为______.用该电池作电源进行粗铜精炼时,当得到64g精铜时,理论上该电池负极消耗的质量为______g.