A~I分别表示中学化学中常见的一种物质,它们之间相互关系如图所示:已知G在生产中可作为一种耐火材料,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素,其中I+B→A+G属于置换反应.(部分反应物、生成物没有列出).请填写下列空白:(1)如何检验D中阳离子:(2)写出反应②的化学方程式:3Fe+4H2O(g) △ . Fe3O4+4H23Fe+4H2O(g) △ . Fe3O4
2019-04-20
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如图所示:已知G在生产中可作为一种耐火材料,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素,其中I+B→A+G属于置换反应.(部分反应物、生成物没有列出).
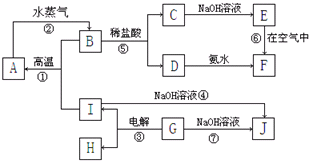
请填写下列空白:
(1)如何检验D中阳离子:______
(2)写出反应②的化学方程式:
写出反应⑦的离子方程式:______
(3)E在空气中变成F的实验现象是______
(4)写出反应⑥的化学方程式并用单线桥标出电子转移的方向和数目:______计算该反应中若转移2mol电子,需要标况下的O2______L.
优质解答
F是红褐色难溶于水的沉淀,则F是Fe(OH)3,E在空气中被氧化生成氢氧化铁,则E是Fe(OH)2,C和氢氧化钠溶液反应生成氢氧化亚铁,根据元素守恒知,C中含有亚铁离子,D和氨水反应生成氢氧化铁,则D中含有铁离子,B和盐酸反应生成亚铁离子、铁离子,则B为Fe3O4,A和水蒸气反应生成四氧化三铁,则A是Fe,I+B→A+G属于置换反应,且该反应在高温条件下反应,则为铝热反应,所以I是Al,G是Al2O3,电解氧化铝生成铝和氧气,所以H是O2,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,所以J是NaAlO2,
(1)D为氯化铁溶液,铁离子和氢氧根离子反应生成红褐色沉淀,和硫氰化钾溶液反应生成血红色溶液,所以可以用氢氧化钠或硫氰化钾溶液检验铁离子,其操作方法是:取一定量的D溶液于试管中,滴加适量的KSCN溶液,若溶液出现血红色,则说明含Fe3+,故答案为:取一定量的D溶液于试管中,滴加适量的KSCN溶液,若溶液出现血红色,则说明含Fe3+;
(2)②铁和水蒸气发生氧化还原反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)Fe3O4+4H2,
⑦氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子反应方程式为:Al2O3+2OH-═2AlO2 -+H2O,
故答案为:3Fe+4H2O(g)Fe3O4+4H2;Al2O3+2OH-═2AlO2 -+H2O;
(3)E是白色的氢氧化亚铁,F是红褐色的氢氧化铁,白色的氢氧化亚铁不溶于水,也不稳定,易被空气中氧气氧化而迅速变为灰绿色,最后变化红褐色,
故答案为:白色沉淀迅速变为灰绿色最后变为红褐色;
(4)氢氧化亚铁被氧气氧化生成氢氧化铁,该反应中铁元素化合价由+4价变为+6价,氧元素化合价由0价变为-2价,得失电子数为4,所以其转移电子的方向和数目为: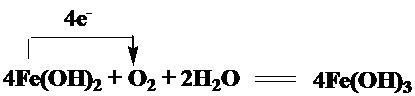 ,
,
根据氧气和转移电子之间的关系式知,需要氧气的体积=×22.4L/mol=11.2L,
故答案为: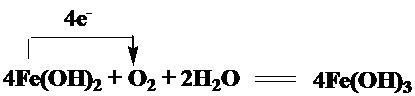 ;11.2.
F是红褐色难溶于水的沉淀,则F是Fe(OH)3,E在空气中被氧化生成氢氧化铁,则E是Fe(OH)2,C和氢氧化钠溶液反应生成氢氧化亚铁,根据元素守恒知,C中含有亚铁离子,D和氨水反应生成氢氧化铁,则D中含有铁离子,B和盐酸反应生成亚铁离子、铁离子,则B为Fe3O4,A和水蒸气反应生成四氧化三铁,则A是Fe,I+B→A+G属于置换反应,且该反应在高温条件下反应,则为铝热反应,所以I是Al,G是Al2O3,电解氧化铝生成铝和氧气,所以H是O2,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,所以J是NaAlO2,
;11.2.
F是红褐色难溶于水的沉淀,则F是Fe(OH)3,E在空气中被氧化生成氢氧化铁,则E是Fe(OH)2,C和氢氧化钠溶液反应生成氢氧化亚铁,根据元素守恒知,C中含有亚铁离子,D和氨水反应生成氢氧化铁,则D中含有铁离子,B和盐酸反应生成亚铁离子、铁离子,则B为Fe3O4,A和水蒸气反应生成四氧化三铁,则A是Fe,I+B→A+G属于置换反应,且该反应在高温条件下反应,则为铝热反应,所以I是Al,G是Al2O3,电解氧化铝生成铝和氧气,所以H是O2,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,所以J是NaAlO2,
(1)D为氯化铁溶液,铁离子和氢氧根离子反应生成红褐色沉淀,和硫氰化钾溶液反应生成血红色溶液,所以可以用氢氧化钠或硫氰化钾溶液检验铁离子,其操作方法是:取一定量的D溶液于试管中,滴加适量的KSCN溶液,若溶液出现血红色,则说明含Fe3+,故答案为:取一定量的D溶液于试管中,滴加适量的KSCN溶液,若溶液出现血红色,则说明含Fe3+;
(2)②铁和水蒸气发生氧化还原反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)Fe3O4+4H2,
⑦氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子反应方程式为:Al2O3+2OH-═2AlO2 -+H2O,
故答案为:3Fe+4H2O(g)Fe3O4+4H2;Al2O3+2OH-═2AlO2 -+H2O;
(3)E是白色的氢氧化亚铁,F是红褐色的氢氧化铁,白色的氢氧化亚铁不溶于水,也不稳定,易被空气中氧气氧化而迅速变为灰绿色,最后变化红褐色,
故答案为:白色沉淀迅速变为灰绿色最后变为红褐色;
(4)氢氧化亚铁被氧气氧化生成氢氧化铁,该反应中铁元素化合价由+4价变为+6价,氧元素化合价由0价变为-2价,得失电子数为4,所以其转移电子的方向和数目为: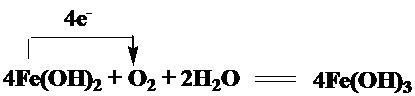 ,
,
根据氧气和转移电子之间的关系式知,需要氧气的体积=×22.4L/mol=11.2L,
故答案为: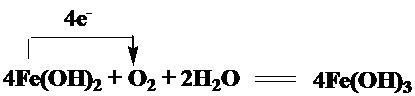 ;11.2.
;11.2.


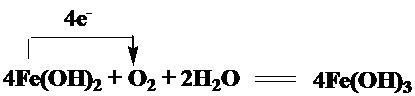 ,
,