CO2和CH4是两种主要的温室气体,以CH4和CO2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:(1)由CO2制取C的太阳能工艺如图1所示.①“热分解系统”发生的反应为2Fe3O4 >2300K . 6F
2019-04-20
CO2和CH4是两种主要的温室气体,以CH4和CO2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
(1)由CO2制取C的太阳能工艺如图1所示.
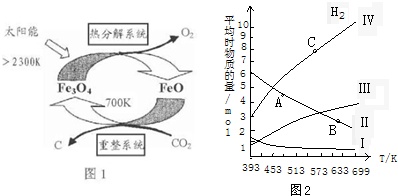
①“热分解系统”发生的反应为2Fe3O4
6FeO+O2↑,每分解lmolFe3O4转移电子的物质的量为___.
②“重整系统”发生反应的化学方程式为___.
(2)一定条件下,CO2和CH4反应可生产合成气(CO、H2的混合气体),其可用于合成多种液体燃料.
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=-802.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.0kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的△H=___kJ•mol-1
(3)CH4也可经催化剂重整生产化工原料,最近科学家们在恒温恒容的密闭体系中利用CH4无氧重整获得芳香烃:8CH4(g)
H2C-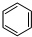 -CH3(g)+11H2△H=kJ•mol-1.
-CH3(g)+11H2△H=kJ•mol-1.
下列有关该反应的说法中正确的是___.
A、可研发新的催化剂,提高CH4的转化率
B、当体系压强不变时,反应达到平衡
C、当有32molC-H键断裂,同时有11molH-H键断裂,反应达到平衡
D、达到平衡时,放出(或吸收)的热量为mkJ
(4)CO2催化加氢可合成低碳烯烃,起始时在0.1MPa下,以n(H2):n(CO2)=3:1的投料比例将反应物放入反应器中,发生反应:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)△H,保持压强不变,不同温度下,平衡时的四种气态物质的量如图2所示:
①曲线Ⅱ表示的物质为___(填化学式),该反应的△H___(填“>”或“<”)0.
②A、B两点对应的反应的反应速率v(A)、v(B)的大小关系为___.B、C两点对应温度下反应的平衡常数大小关系为K(B)___(填“>”“<”或“=”)K(C)
③为提高CO2平衡转化率,除改变温度外,还可以采取的措施是___.(举一种)
(1)由CO2制取C的太阳能工艺如图1所示.

①“热分解系统”发生的反应为2Fe3O4
| ||
②“重整系统”发生反应的化学方程式为___.
(2)一定条件下,CO2和CH4反应可生产合成气(CO、H2的混合气体),其可用于合成多种液体燃料.
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=-802.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.0kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的△H=___kJ•mol-1
(3)CH4也可经催化剂重整生产化工原料,最近科学家们在恒温恒容的密闭体系中利用CH4无氧重整获得芳香烃:8CH4(g)
| 2MPa,550℃ |
| |
| Pt |
 -CH3(g)+11H2△H=kJ•mol-1.
-CH3(g)+11H2△H=kJ•mol-1.下列有关该反应的说法中正确的是___.
A、可研发新的催化剂,提高CH4的转化率
B、当体系压强不变时,反应达到平衡
C、当有32molC-H键断裂,同时有11molH-H键断裂,反应达到平衡
D、达到平衡时,放出(或吸收)的热量为mkJ
(4)CO2催化加氢可合成低碳烯烃,起始时在0.1MPa下,以n(H2):n(CO2)=3:1的投料比例将反应物放入反应器中,发生反应:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)△H,保持压强不变,不同温度下,平衡时的四种气态物质的量如图2所示:
①曲线Ⅱ表示的物质为___(填化学式),该反应的△H___(填“>”或“<”)0.
②A、B两点对应的反应的反应速率v(A)、v(B)的大小关系为___.B、C两点对应温度下反应的平衡常数大小关系为K(B)___(填“>”“<”或“=”)K(C)
③为提高CO2平衡转化率,除改变温度外,还可以采取的措施是___.(举一种)