优质解答
由元素在周期表中位置知①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Cl、⑨为Fe、⑩为Cu.
(1)元素⑩位于周期表中ds区,根据核外电子排布规律,其电子排布式为:1s22s22p63s23p63d104s1,
故答案为:ds;1s22s22p63s23p63d104s1;
(2)由元素⑨在元素周期表中的位置,可知其位于第四周期第Ⅷ族;原子核外有26个电子,由核外电子排布规律,可知各层电子数为2、8、14、2,原子结构示意图为: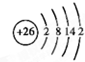 ,
,
故答案为:第四周期第Ⅷ族; ;
;
(3)元素⑤的原子的价层电子排布式为2s22p4,其价电子排布图为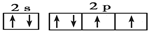 ,O2-最外层有8个电子,带2个单位负电荷,电子式为:
,O2-最外层有8个电子,带2个单位负电荷,电子式为: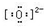 ,
,
故答案为: ;
;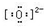 ;
;
(4)元素①与④形成的常见化合物为NH3,N原子价层电子对数=3+
=4,采取sp3杂化,VSEPR模型为正四面体,N原子孤电子对数为1,其空间构型为三角锥形,
故答案为:sp3;正四面体;三角锥形;
(5)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(Cl-)>r(O2-)>r(F-)>r(Mg2+),
故答案为:r(Cl-)>r(O2-)>r(F-)>r(Mg2+);
(6)①③④⑤中的某两种元素可形成均含10个电子的互为等电子体的两组微粒,为NH4+ 和CH4,H3O+和 NH3,
故答案为:NH4+ 和CH4;H3O+和 NH3;
(7)将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到[Cu(NH3)4]2+络离子,中心离子配位数为4,反应涉及的离子方程式为:Cu2++2NH3.H2O═Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3.H2O═Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-;4. 由元素在周期表中位置知①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Cl、⑨为Fe、⑩为Cu.
(1)元素⑩位于周期表中ds区,根据核外电子排布规律,其电子排布式为:1s22s22p63s23p63d104s1,
故答案为:ds;1s22s22p63s23p63d104s1;
(2)由元素⑨在元素周期表中的位置,可知其位于第四周期第Ⅷ族;原子核外有26个电子,由核外电子排布规律,可知各层电子数为2、8、14、2,原子结构示意图为: ,
,
故答案为:第四周期第Ⅷ族; ;
;
(3)元素⑤的原子的价层电子排布式为2s22p4,其价电子排布图为 ,O2-最外层有8个电子,带2个单位负电荷,电子式为:
,O2-最外层有8个电子,带2个单位负电荷,电子式为: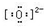 ,
,
故答案为: ;
;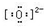 ;
;
(4)元素①与④形成的常见化合物为NH3,N原子价层电子对数=3+
=4,采取sp3杂化,VSEPR模型为正四面体,N原子孤电子对数为1,其空间构型为三角锥形,
故答案为:sp3;正四面体;三角锥形;
(5)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(Cl-)>r(O2-)>r(F-)>r(Mg2+),
故答案为:r(Cl-)>r(O2-)>r(F-)>r(Mg2+);
(6)①③④⑤中的某两种元素可形成均含10个电子的互为等电子体的两组微粒,为NH4+ 和CH4,H3O+和 NH3,
故答案为:NH4+ 和CH4;H3O+和 NH3;
(7)将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到[Cu(NH3)4]2+络离子,中心离子配位数为4,反应涉及的离子方程式为:Cu2++2NH3.H2O═Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3.H2O═Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-;4.
(1)元素⑩位于周期表中ds区,根据核外电子排布规律,其电子排布式为:1s22s22p63s23p63d104s1,
故答案为:ds;1s22s22p63s23p63d104s1;
(2)由元素⑨在元素周期表中的位置,可知其位于第四周期第Ⅷ族;原子核外有26个电子,由核外电子排布规律,可知各层电子数为2、8、14、2,原子结构示意图为:
 ,
,故答案为:第四周期第Ⅷ族;
 ;
;(3)元素⑤的原子的价层电子排布式为2s22p4,其价电子排布图为
 ,O2-最外层有8个电子,带2个单位负电荷,电子式为:
,O2-最外层有8个电子,带2个单位负电荷,电子式为: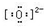 ,
,故答案为:
 ;
;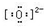 ;
;(4)元素①与④形成的常见化合物为NH3,N原子价层电子对数=3+
| 5−1×3 |
| 2 |
故答案为:sp3;正四面体;三角锥形;
(5)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(Cl-)>r(O2-)>r(F-)>r(Mg2+),
故答案为:r(Cl-)>r(O2-)>r(F-)>r(Mg2+);
(6)①③④⑤中的某两种元素可形成均含10个电子的互为等电子体的两组微粒,为NH4+ 和CH4,H3O+和 NH3,
故答案为:NH4+ 和CH4;H3O+和 NH3;
(7)将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到[Cu(NH3)4]2+络离子,中心离子配位数为4,反应涉及的离子方程式为:Cu2++2NH3.H2O═Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3.H2O═Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-;4. 由元素在周期表中位置知①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Cl、⑨为Fe、⑩为Cu.
(1)元素⑩位于周期表中ds区,根据核外电子排布规律,其电子排布式为:1s22s22p63s23p63d104s1,
故答案为:ds;1s22s22p63s23p63d104s1;
(2)由元素⑨在元素周期表中的位置,可知其位于第四周期第Ⅷ族;原子核外有26个电子,由核外电子排布规律,可知各层电子数为2、8、14、2,原子结构示意图为:
 ,
,故答案为:第四周期第Ⅷ族;
 ;
;(3)元素⑤的原子的价层电子排布式为2s22p4,其价电子排布图为
 ,O2-最外层有8个电子,带2个单位负电荷,电子式为:
,O2-最外层有8个电子,带2个单位负电荷,电子式为: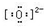 ,
,故答案为:
 ;
;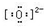 ;
;(4)元素①与④形成的常见化合物为NH3,N原子价层电子对数=3+
| 5−1×3 |
| 2 |
故答案为:sp3;正四面体;三角锥形;
(5)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(Cl-)>r(O2-)>r(F-)>r(Mg2+),
故答案为:r(Cl-)>r(O2-)>r(F-)>r(Mg2+);
(6)①③④⑤中的某两种元素可形成均含10个电子的互为等电子体的两组微粒,为NH4+ 和CH4,H3O+和 NH3,
故答案为:NH4+ 和CH4;H3O+和 NH3;
(7)将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到[Cu(NH3)4]2+络离子,中心离子配位数为4,反应涉及的离子方程式为:Cu2++2NH3.H2O═Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3.H2O═Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-;4.