生物实验小组探究选稻种的实验,需配制质量分数为10%的氯化钠溶液105g,实验操作步骤如图所示:(1)计算应称取氯化钠g,需加水mL(把水的密度近似看作lg/cm3).(2)如果配制的氯化钠溶液溶质质量分数小于10%,则造成误差的原因可能有?(请举两条)①,②.
2019-06-20
生物实验小组探究选稻种的实验,需配制质量分数为10%的氯化钠溶液105g,实验操作步骤如图所示:
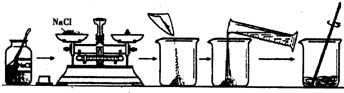
(1)计算应称取氯化钠______g,需加水______mL(把水的密度近似看作lg/cm3).
(2)如果配制的氯化钠溶液溶质质量分数小于10%,则造成误差的原因可能有?(请举两条)
①______,②______.

(1)计算应称取氯化钠______g,需加水______mL(把水的密度近似看作lg/cm3).
(2)如果配制的氯化钠溶液溶质质量分数小于10%,则造成误差的原因可能有?(请举两条)
①______,②______.