【化学——选修3:物质结构与性质】(15分) 碳族元素C、Si、Ge的单质及其化合物在材料、医药等方面有重要的应用。请回答下列问题。 (1)Ge原子核外电子排布式为。 (2)C元素的三种单质的晶体结构如图。 ①金刚石晶体中碳原子与碳碳键的个数比为;石墨晶体中碳原子的杂化类型为。 ②石墨烯是从石墨材料中剥离出来的、由单层碳原子组成的二维晶体,每个碳原子提供一个p轨道上的电子形成大π键,π电子可以自由移动。将氢气加入到石墨烯中可制得一种新材料石墨烷。下列判断错误的是. A.石墨烯是电的良导
2019-05-22
【化学——选修3:物质结构与性质】(15分)
碳族元素C、Si、Ge的单质及其化合物在材料、医药等方面有重要的应用。请回答下列问题。
(1)Ge原子核外电子排布式为________________________。
(2)C元素的三种单质的晶体结构如图。
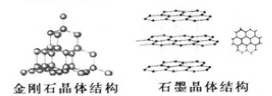
①金刚石晶体中碳原子与碳碳键的个数比为______;石墨晶体中碳原子的杂化类型为__________。
②石墨烯是从石墨材料中剥离出来的、由单层碳原子组成的二维晶体,每个碳原子提供一个p轨道上的电子形成大π键,π电子可以自由移动。将氢气加入到石墨烯中可制得一种新材料石墨烷。下列判断错误的是_______.
A.石墨烯是电的良导体而石墨烷则为绝缘体
B.石墨烯是一种强度很高的材料
C.石墨烯与石墨烷均为高分子化合物
D.石墨烯与H2制得石墨烷的反应属于加成反应
(3)碳元素的电负性比硅元素_______(填“大”或“小”)。CO2分子中碳氧原子之间化学键的成键方式为_________________。
(4)CO可以和很多金属形成配合物,如Ni(CO)4。
①其中Ni与CO之间的键型为_______。Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,则固态Ni(CO)4属于________晶体。
②与配体CO互为等电子体的阴离子有________(任写一种)。NH3也可作为很多配合物的配体。其中N原子的杂化类型为_____________。若配离子[Ni(NH3)6]2-为正八面体结构,则[Ni(CO)2(NH3)4]2+的结构有____________种。