现有100g盐酸和CaCl2的混合溶液,向其中逐滴加入10%的纯碱溶液至过量,溶液的pH随滴入纯碱溶液质量的变化关系如图所示.(1)请依次写出发生反应的化学方程式:.(2)A点对应的溶液中的溶质是(用化学式表示)(3)B点对应溶液中溶质的质量分数.
2019-04-20
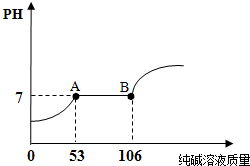 现有100g盐酸和CaCl2的混合溶液,向其中逐滴加入10%的纯碱溶液至过量,溶液的pH随滴入纯碱溶液质量的变化关系如图所示.
现有100g盐酸和CaCl2的混合溶液,向其中逐滴加入10%的纯碱溶液至过量,溶液的pH随滴入纯碱溶液质量的变化关系如图所示.
(1)请依次写出发生反应的化学方程式:______.
(2)A点对应的溶液中的溶质是______(用化学式表示)
(3)B点对应溶液中溶质的质量分数.
优质解答
(1)碳酸钠首先与盐酸反应,反应完成后,碳酸钠再与氯化钙反应生成沉淀;故依次发生反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;CaCl2+Na2CO3=2NaCl+CaCO3↓
故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;CaCl2+Na2CO3=2NaCl+CaCO3↓
(2)到A点时盐酸已反应完,氯化钙还未发生反应,故A点对应的溶液中的溶质有碳酸钠与盐酸反应生成的氯化钠和未发生反应的氯化钙;故答案为:NaCl、CaCl2
(3)碳酸钠与盐酸及氯化钙完全反应都得到氯化钠溶液,完全反应所消耗碳酸钠溶液的质量为106g;
则碳酸钠的质量为:106g×10%═10.6g
其中钠元素质量=10.6g××100%=4.6g,
则溶液恰好完全反应时所得溶液中所含溶质氯化钠质量=4.6g÷×100%=11.7g
设碳酸钠与盐酸反应生成二氧化碳的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
53g×10% x
=
x=2.2g
设碳酸钠与氯化钙反应生成碳酸钙的质量为y
CaCl2+Na2CO3 =2NaCl+CaCO3↓
106 100
(106g-53g)×10% y
=
y=5g
(3)B点对应溶液中溶质的质量分数为:×100%=5.9%
答:B点对应溶液中溶质氯化钠的质量分数为5.9%
(1)碳酸钠首先与盐酸反应,反应完成后,碳酸钠再与氯化钙反应生成沉淀;故依次发生反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;CaCl2+Na2CO3=2NaCl+CaCO3↓
故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;CaCl2+Na2CO3=2NaCl+CaCO3↓
(2)到A点时盐酸已反应完,氯化钙还未发生反应,故A点对应的溶液中的溶质有碳酸钠与盐酸反应生成的氯化钠和未发生反应的氯化钙;故答案为:NaCl、CaCl2
(3)碳酸钠与盐酸及氯化钙完全反应都得到氯化钠溶液,完全反应所消耗碳酸钠溶液的质量为106g;
则碳酸钠的质量为:106g×10%═10.6g
其中钠元素质量=10.6g××100%=4.6g,
则溶液恰好完全反应时所得溶液中所含溶质氯化钠质量=4.6g÷×100%=11.7g
设碳酸钠与盐酸反应生成二氧化碳的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
53g×10% x
=
x=2.2g
设碳酸钠与氯化钙反应生成碳酸钙的质量为y
CaCl2+Na2CO3 =2NaCl+CaCO3↓
106 100
(106g-53g)×10% y
=
y=5g
(3)B点对应溶液中溶质的质量分数为:×100%=5.9%
答:B点对应溶液中溶质氯化钠的质量分数为5.9%
 现有100g盐酸和CaCl2的混合溶液,向其中逐滴加入10%的纯碱溶液至过量,溶液的pH随滴入纯碱溶液质量的变化关系如图所示.
现有100g盐酸和CaCl2的混合溶液,向其中逐滴加入10%的纯碱溶液至过量,溶液的pH随滴入纯碱溶液质量的变化关系如图所示. 现有100g盐酸和CaCl2的混合溶液,向其中逐滴加入10%的纯碱溶液至过量,溶液的pH随滴入纯碱溶液质量的变化关系如图所示.
现有100g盐酸和CaCl2的混合溶液,向其中逐滴加入10%的纯碱溶液至过量,溶液的pH随滴入纯碱溶液质量的变化关系如图所示.