纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到.[已知:硫酸铝铵晶体的倾学式为(NH4)Al(SO4)n•12H2O].制备硫酸铝铵晶体的实验流程如图(1):(1)检验上述流程中“过滤”后杂质是否除尽的实验方法是.(2)上述流程中,“分离”所包含的操作依次为:、、过滤、洗涤、干燥.(3)硫酸铝铵水溶液呈酸性的原因是(用离子方程式表示).(4)写出上述“反应Ⅱ”中获得硫酸铝铵晶体的化学方程式.(5)向硫酸铝铵溶液中加入氢氧化钡溶液至A13+刚好沉淀完全,写出反
2020-02-08
纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到.[已知:硫酸铝铵晶体的倾学式为(NH4)Al(SO4)n•12H2O].制备硫酸铝铵晶体的实验流程如图(1):
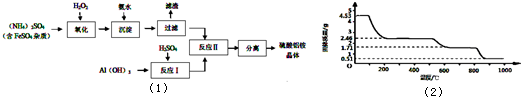
(1)检验上述流程中“过滤”后杂质是否除尽的实验方法是______.
(2)上述流程中,“分离”所包含的操作依次为:______、______、过滤、洗涤、干燥.
(3)硫酸铝铵水溶液呈酸性的原因是______(用离子方程式表示).
(4)写出上述“反应Ⅱ”中获得硫酸铝铵晶体的化学方程式______.
(5)向硫酸铝铵溶液中加入氢氧化钡溶液至A13+刚好沉淀完全,写出反应的离子方程式______.
(6)取4.53g硫酸铝铵晶体加热分解,加热过程中,固体质量随时间的变化如图(2)所示:写出400℃时剩余固体成分的化学式______.
优质解答
(1)由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后的滤液中可能含有Fe3+,取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽.
故答案为:取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽.
(2)由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
故答案为:蒸发浓缩、冷却结晶.
(3)溶液中Al3+水解Al3++3H2O⇌Al(OH)3+H+,NH4+水解NH4++H2O⇌NH3•H2O+H+,使溶液呈酸性.
故答案为:Al3++3H2O⇌Al(OH)3+H+,NH4++H2O⇌NH3•H2O+H+.
(4)硫酸铝溶液与硫酸铵溶液反应生成(NH4)Al(SO4)2•12H2O,
反应方程式为Al2(SO4)3+(NH4)2SO4+24H2O=2(NH4)Al(SO4)2•12H2O.
故答案为:Al2(SO4)3+(NH4)2SO4+24H2O=2(NH4)Al(SO4)2•12H2O.
(5)向硫酸铝铵溶液中加入氢氧化钡溶液至A13+刚好沉淀完全,OH-与Al3+反应,NH4+不反应,反应为硫酸铝与氢氧化钡,反应离子方程式为2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓.
故答案为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓.
(6)取4.53g硫酸铝铵晶体的物质的量为=0.01mol,
4.53g硫酸铝铵晶体中水的质量为0.01mol×12×18g/mol=2.16g,
加热400℃时固体质量减少△m=4.53g-2.46g=2.07g<2.16g
剩余固体中结晶水的物质的量为=0.005mol.
剩余固体中n[(NH4)Al(SO4)2]:n(H2O)=0.01mol:0.005mol=2:1,
故400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O.
故答案为:(NH4)2Al2(SO4)4•H2O.
(1)由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后的滤液中可能含有Fe3+,取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽.
故答案为:取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽.
(2)由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
故答案为:蒸发浓缩、冷却结晶.
(3)溶液中Al3+水解Al3++3H2O⇌Al(OH)3+H+,NH4+水解NH4++H2O⇌NH3•H2O+H+,使溶液呈酸性.
故答案为:Al3++3H2O⇌Al(OH)3+H+,NH4++H2O⇌NH3•H2O+H+.
(4)硫酸铝溶液与硫酸铵溶液反应生成(NH4)Al(SO4)2•12H2O,
反应方程式为Al2(SO4)3+(NH4)2SO4+24H2O=2(NH4)Al(SO4)2•12H2O.
故答案为:Al2(SO4)3+(NH4)2SO4+24H2O=2(NH4)Al(SO4)2•12H2O.
(5)向硫酸铝铵溶液中加入氢氧化钡溶液至A13+刚好沉淀完全,OH-与Al3+反应,NH4+不反应,反应为硫酸铝与氢氧化钡,反应离子方程式为2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓.
故答案为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓.
(6)取4.53g硫酸铝铵晶体的物质的量为=0.01mol,
4.53g硫酸铝铵晶体中水的质量为0.01mol×12×18g/mol=2.16g,
加热400℃时固体质量减少△m=4.53g-2.46g=2.07g<2.16g
剩余固体中结晶水的物质的量为=0.005mol.
剩余固体中n[(NH4)Al(SO4)2]:n(H2O)=0.01mol:0.005mol=2:1,
故400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O.
故答案为:(NH4)2Al2(SO4)4•H2O.

