氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题: (1)氮化镓电极为极,写出铜电极表面的电极反应式的;(2)电池内部H+流动的方向为(填“从右向左”或“从左向右”);(3)电路中每产生1mol电子,理论上可以生成标准状况下的O2L.(4)为提高该人工光合系统的工作效率,可向装置中加入少量的酸,最好选择(选填“盐酸”“硝酸”或“硫酸”).
2019-04-20
氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题:
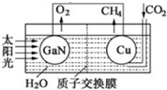
(1)氮化镓电极为___极,写出铜电极表面的电极反应式的___;
(2)电池内部H+流动的方向为___(填“从右向左”或“从左向右”);
(3)电路中每产生1mol电子,理论上可以生成标准状况下的O2___L.
(4)为提高该人工光合系统的工作效率,可向装置中加入少量的酸,最好选择___(选填“盐酸”“硝酸”或“硫酸”).

(1)氮化镓电极为___极,写出铜电极表面的电极反应式的___;
(2)电池内部H+流动的方向为___(填“从右向左”或“从左向右”);
(3)电路中每产生1mol电子,理论上可以生成标准状况下的O2___L.
(4)为提高该人工光合系统的工作效率,可向装置中加入少量的酸,最好选择___(选填“盐酸”“硝酸”或“硫酸”).