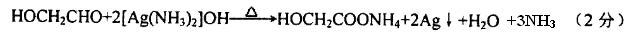(10分)煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:C+H 2 O(g)——CO+H 2 ,CO和H 2 的混合气体是合成多种有机物的原料气。下图是合成某些物质的路线。其中,D易溶于水,且与CH 3 COOH互为同分异构体,既能与银氨溶液反应,又能发生酯化反应;F分子中的碳原子数是D的3倍;H经催化氧化可得到G。请回答下列问题: (1)写出下列物质的结构简式:EB;E与H是否属于同系物:(填是或否)。(2)D的同分异构体除CH 3 COOH外还有:;(3)写出下列反应的化学方程式:
2019-06-25
| (10分)煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:C+H 2 O(g)——CO+H 2 ,CO和H 2 的混合气体是合成多种有机物的原料气。下图是合成某些物质的路线。其中,D易溶于水,且与CH 3 COOH互为同分异构体,既能与银氨溶液反应,又能发生酯化反应;F分子中的碳原子数是D的3倍;H经催化氧化可得到G。请回答下列问题: 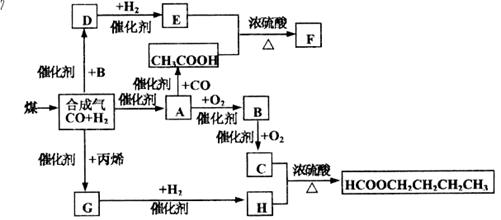 (1)写出下列物质的结构简式:E___________B__________;E与H是否属于同系物:________________(填是或否)。 (2)D的同分异构体除CH 3 COOH外还有:___________________; (3)写出下列反应的化学方程式: C+H_____________________________________________; D与银氨溶液反应________________________________________。 (4)A为工业常用燃料。某同学将A完全燃烧,产生的二氧化碳气体通入澄清石灰水中。 若该同学实验时共取了200mL0.1mol/L的石灰水,通入一定量的二氧化碳后,得到1g沉淀,那么,他通入的二氧化碳标况下的体积可能为___________________________。 |