中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.回答下列问题: (1)氮、磷、钾三种元素的第一电离能由大到小的顺序是cm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值).
2019-04-20
中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.
回答下列问题:
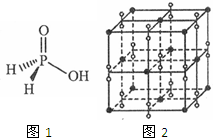
(1)氮、磷、钾三种元素的第一电离能由大到小的顺序是___cm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值).
回答下列问题:

(1)氮、磷、钾三种元素的第一电离能由大到小的顺序是___cm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值).