NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2继而生产Ni2O3的工艺流程如下:如表,列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算). 氢氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Ni(OH)2 开始沉淀的pH 1.1 6.5 3.5 7.1 沉淀完全的pH 3.2 9.7 4.7 9.2 (1)为了提高金属镍废料浸出的速率,在
2019-11-27
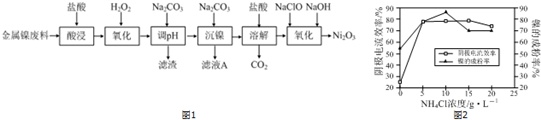
NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2继而生产Ni2O3的工艺流程如下:
如表,列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③___等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为___.
(3)从滤液A中可回收利用的主要物质是___.
(4)“氧化”生成Ni2O3的离子方程式为___.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为___.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:___.

如表,列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为___.
(3)从滤液A中可回收利用的主要物质是___.
(4)“氧化”生成Ni2O3的离子方程式为___.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为___.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:___.