优质解答
由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar,⑨为K、⑩为Br.
(1)⑩是Br元素,原子核内有35个质子,原子结构示意图为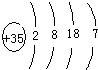 ,
,
故答案为: ;
;
(2)①的最高价氧化物是CO2,电子式为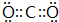 ;②的单质是N2,电子式为
;②的单质是N2,电子式为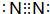 ,
,
故答案为: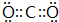 ;
;
(3)③与④形成化合物是MgF2,属于离子化合物,Mg失去2个电子成为镁离子,F得到1个电子成为氟离子,用电子式表示其形成过程是: ,
,
故答案为: ;
;
(4)①的单质和⑥的氧化物反应即C与二氧化硅高温下发生置换反应,化学方程式为:2C+SiO2
Si+2CO↑,
故答案为:2C+SiO2
Si+2CO↑;
(5)⑤是Al,与氢氧化钠反应的化学方程式为:2Al+2H2O+NaOH=2NaAlO2+3H2↑;氢氧化铝与氢氧化钠溶液反应的离子方程式为:Al(OH)3+OH-=AlO-2+2H2O,
故答案为:2Al+2H2O+NaOH=2NaAlO2+3H2↑;Al(OH)3+OH-=AlO-2+2H2O;
(6)甲烷与氧气燃烧的化学方程式为:CH4+2O2
CO2+2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol=-660 kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量,故答案为:660.
由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar,⑨为K、⑩为Br.
(1)⑩是Br元素,原子核内有35个质子,原子结构示意图为 ,
,
故答案为: ;
;
(2)①的最高价氧化物是CO2,电子式为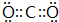 ;②的单质是N2,电子式为
;②的单质是N2,电子式为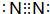 ,
,
故答案为: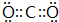 ;
;
(3)③与④形成化合物是MgF2,属于离子化合物,Mg失去2个电子成为镁离子,F得到1个电子成为氟离子,用电子式表示其形成过程是: ,
,
故答案为: ;
;
(4)①的单质和⑥的氧化物反应即C与二氧化硅高温下发生置换反应,化学方程式为:2C+SiO2
Si+2CO↑,
故答案为:2C+SiO2
Si+2CO↑;
(5)⑤是Al,与氢氧化钠反应的化学方程式为:2Al+2H2O+NaOH=2NaAlO2+3H2↑;氢氧化铝与氢氧化钠溶液反应的离子方程式为:Al(OH)3+OH-=AlO-2+2H2O,
故答案为:2Al+2H2O+NaOH=2NaAlO2+3H2↑;Al(OH)3+OH-=AlO-2+2H2O;
(6)甲烷与氧气燃烧的化学方程式为:CH4+2O2
CO2+2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol=-660 kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量,故答案为:660.
(1)⑩是Br元素,原子核内有35个质子,原子结构示意图为
 ,
,故答案为:
 ;
;(2)①的最高价氧化物是CO2,电子式为
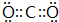 ;②的单质是N2,电子式为
;②的单质是N2,电子式为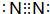 ,
,故答案为:
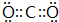 ;
;(3)③与④形成化合物是MgF2,属于离子化合物,Mg失去2个电子成为镁离子,F得到1个电子成为氟离子,用电子式表示其形成过程是:
 ,
,故答案为:
 ;
;(4)①的单质和⑥的氧化物反应即C与二氧化硅高温下发生置换反应,化学方程式为:2C+SiO2
| ||
故答案为:2C+SiO2
| ||
(5)⑤是Al,与氢氧化钠反应的化学方程式为:2Al+2H2O+NaOH=2NaAlO2+3H2↑;氢氧化铝与氢氧化钠溶液反应的离子方程式为:Al(OH)3+OH-=AlO-2+2H2O,
故答案为:2Al+2H2O+NaOH=2NaAlO2+3H2↑;Al(OH)3+OH-=AlO-2+2H2O;
(6)甲烷与氧气燃烧的化学方程式为:CH4+2O2
| ||
(1)⑩是Br元素,原子核内有35个质子,原子结构示意图为
 ,
,故答案为:
 ;
;(2)①的最高价氧化物是CO2,电子式为
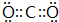 ;②的单质是N2,电子式为
;②的单质是N2,电子式为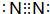 ,
,故答案为:
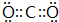 ;
;(3)③与④形成化合物是MgF2,属于离子化合物,Mg失去2个电子成为镁离子,F得到1个电子成为氟离子,用电子式表示其形成过程是:
 ,
,故答案为:
 ;
;(4)①的单质和⑥的氧化物反应即C与二氧化硅高温下发生置换反应,化学方程式为:2C+SiO2
| ||
故答案为:2C+SiO2
| ||
(5)⑤是Al,与氢氧化钠反应的化学方程式为:2Al+2H2O+NaOH=2NaAlO2+3H2↑;氢氧化铝与氢氧化钠溶液反应的离子方程式为:Al(OH)3+OH-=AlO-2+2H2O,
故答案为:2Al+2H2O+NaOH=2NaAlO2+3H2↑;Al(OH)3+OH-=AlO-2+2H2O;
(6)甲烷与氧气燃烧的化学方程式为:CH4+2O2
| ||