随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.5kJ•mol-1①该反应的平衡常数表达式为c(CO)c(H2)c(H2O)c(CO)c(H2)c(H2O).②下列措施中,不能提高碳的转化率的是(填字母序号)a.容器的体积不变,增加水蒸气的物质的量 b.缩小容器的体积
 随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.5kJ•mol-1
①该反应的平衡常数表达式为
.
②下列措施中,不能提高碳的转化率的是______(填字母序号)
a.容器的体积不变,增加水蒸气的物质的量 b.缩小容器的体积,增大压强
c.及时将水煤气从容器中移走 d.其他条件不变,升高温度
③又知C(s)+CO2 (g)⇌2CO(g)△H=+172.5kJ•mol-1
则CO(g)+H2O(g)⇌CO2 (g)+H2(g)的焓变(△H)为______.
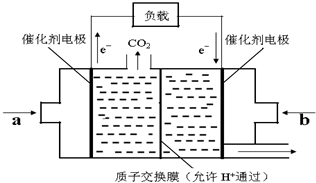
(2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)⇌CH3OH(g).甲醇作为一种可再生能源燃料,可用于燃料电池.如图是甲醇燃料电池的原理示意图:
①a处通入的是______(填物质名称),该电池工作过程中,H+的移动方向为从______到______(填“左”或“右”).
②该电池正极反应式为______.
③若用该电池提供的电能电解600ml 0.2mol•L-1NaCl溶液,设有0.01mol CH3OH完全放电,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解时阴极反应式为______,电解结束后所得溶液的pH=______.若向电解后的溶液加入适量的醋酸至溶液的pH恰好等于7(反应前后忽略溶液体积的变化),则此时溶液中c(Na+):c(CH3COO-)=______.
2019-04-20
 随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.5kJ•mol-1
①该反应的平衡常数表达式为
| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
②下列措施中,不能提高碳的转化率的是______(填字母序号)
a.容器的体积不变,增加水蒸气的物质的量 b.缩小容器的体积,增大压强
c.及时将水煤气从容器中移走 d.其他条件不变,升高温度
③又知C(s)+CO2 (g)⇌2CO(g)△H=+172.5kJ•mol-1
则CO(g)+H2O(g)⇌CO2 (g)+H2(g)的焓变(△H)为______.
(2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)⇌CH3OH(g).甲醇作为一种可再生能源燃料,可用于燃料电池.如图是甲醇燃料电池的原理示意图:
①a处通入的是______(填物质名称),该电池工作过程中,H+的移动方向为从______到______(填“左”或“右”).
②该电池正极反应式为______.
③若用该电池提供的电能电解600ml 0.2mol•L-1NaCl溶液,设有0.01mol CH3OH完全放电,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解时阴极反应式为______,电解结束后所得溶液的pH=______.若向电解后的溶液加入适量的醋酸至溶液的pH恰好等于7(反应前后忽略溶液体积的变化),则此时溶液中c(Na+):c(CH3COO-)=______.