硼镁泥是一种工业废料,主要成分是MgO(约占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如图:(1)实验中需要1.00mol/L的硫酸1000mL,若用98%的浓硫酸(p=1.84g/mL)来配制.下列所给的容器中,属于配制该硫酸溶液必须使用的有(填写选项字母)A.容量瓶B.分液漏斗C.蒸馏烧瓶D.烧杯E.玻璃棒F.天平(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+
2019-04-22
硼镁泥是一种工业废料,主要成分是MgO(约占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如图:
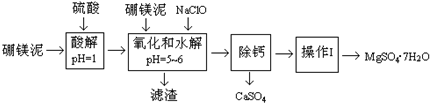
(1)实验中需要1.00mol/L的硫酸1000mL,若用98%的浓硫酸(p=1.84g/mL)来配制.下列所给的容器中,属于配制该硫酸溶液必须使用的有______(填写选项字母)
A.容量瓶B.分液漏斗C.蒸馏烧瓶D.烧杯E.玻璃棒F.天平
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl+,还有一种离子也会被NaClO氧化,该反应的离子方程式为______
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有______
(4)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是______
(5)已知MgSO4、CaSO4的溶解度如下表
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据简要说明操作步骤______
(6)“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO4•7H2O.

(1)实验中需要1.00mol/L的硫酸1000mL,若用98%的浓硫酸(p=1.84g/mL)来配制.下列所给的容器中,属于配制该硫酸溶液必须使用的有______(填写选项字母)
A.容量瓶B.分液漏斗C.蒸馏烧瓶D.烧杯E.玻璃棒F.天平
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl+,还有一种离子也会被NaClO氧化,该反应的离子方程式为______
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有______
(4)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是______
(5)已知MgSO4、CaSO4的溶解度如下表
| 温度(°C) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.197 |
(6)“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO4•7H2O.