(2014•衡阳三模)实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)c(CO)•c(H2),它所对应的化学反应为:.(2)已知在一定温度下,①C(s)+CO2(g)⇌2CO(g)△H1=a kJ/mol;平衡常数K1;②CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2=b 
2019-11-28
(2014•衡阳三模)实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=
,它所对应的化学反应为:______.
(2)已知在一定温度下,
①C(s)+CO2(g)⇌2CO(g)△H1=a kJ/mol;平衡常数K1;
②CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2=b kJ/mol;平衡常数K2;
③C(s)+H2O(g)⇌CO(g)+H2(g)△H3;平衡常数K3.
则K1、K2、K3之间的关系是:______,△H3=______(用含a、b的代数式表示).
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)⇌H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:______.
(4)在催化剂存在条件下反应:H2O(g)+CO(g)⇌CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如图1所示:
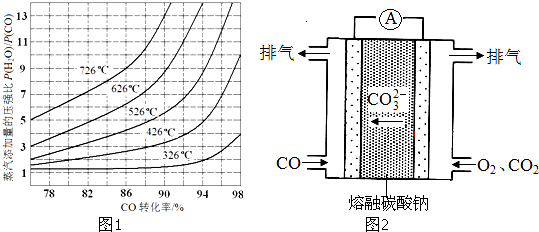
对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=
,提高
比,则KP______(填“变大”、“变小”或“不变”).实际上,在使用铁镁催化剂的工业流程中,一般采用400℃左右、
=3~5.其原因可能是______.
(5)工业上可利用原电池原理除去工业尾气中的CO并利用其电能,反应装置如图2所示,请写出负极的电极反应式:______.
(1)已知某温度下某反应的化学平衡常数表达式为:K=
| c(H2O) |
| c(CO)•c(H2) |
(2)已知在一定温度下,
①C(s)+CO2(g)⇌2CO(g)△H1=a kJ/mol;平衡常数K1;
②CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2=b kJ/mol;平衡常数K2;
③C(s)+H2O(g)⇌CO(g)+H2(g)△H3;平衡常数K3.
则K1、K2、K3之间的关系是:______,△H3=______(用含a、b的代数式表示).
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)⇌H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)在催化剂存在条件下反应:H2O(g)+CO(g)⇌CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如图1所示:

对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=
| P(CO2)P(H2) |
| P(CO)P(H2O) |
| P(CO2)P(H2) |
| P(CO)P(H2O) |
| P[H2O(g)] |
| P(CO) |
| P[H2O(g)] |
| P(CO) |
(5)工业上可利用原电池原理除去工业尾气中的CO并利用其电能,反应装置如图2所示,请写出负极的电极反应式:______.