红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的基本化工原料,应用领域十分广泛.(1)实验室中红矾钠可用铬铁矿(主要成分:FeO.Cr2O3)利用以下过程来制取.①步骤I中反应的化学方程式为:4FeO•Cr2O3(s)+8Na2CO3(s)+7O2═8Na2CrO4(s)+2Fe2O3(s)+8CO2该反应的化学平衡常数的表达式为.在常温下该反应速度极慢,下列措施中能使反应速率增大的是.A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量②步骤Ⅱ中
2019-04-14
红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的基本化工原料,应用领域十分广泛.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO.Cr2O3)利用以下过程来制取.
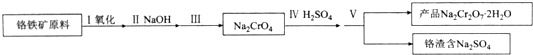
①步骤I中反应的化学方程式为:4FeO•Cr2O3(s)+8Na2CO3(s)+7O2═8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为___.在常温下该反应速度极慢,下列措施中能使反应速率增大的是___.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是___.
③步骤Ⅲ需将溶液的pH调至7〜8并煮沸,其目的是___.
④步骤IV中发生反应的离子方程式为___
(2)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4+2KCl═K2Cr2O7+2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;②___; ③___ ④冷却、结晶,过滤,得到K2Cr2O7晶体.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO.Cr2O3)利用以下过程来制取.

①步骤I中反应的化学方程式为:4FeO•Cr2O3(s)+8Na2CO3(s)+7O2═8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为___.在常温下该反应速度极慢,下列措施中能使反应速率增大的是___.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是___.
③步骤Ⅲ需将溶液的pH调至7〜8并煮沸,其目的是___.
④步骤IV中发生反应的离子方程式为___
(2)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4+2KCl═K2Cr2O7+2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;②___; ③___ ④冷却、结晶,过滤,得到K2Cr2O7晶体.