研究物质的合成或制备是有机化学、无机化学的重要任务之一.(1)某实验小组探究实验室制备无水氯化镁的方法,设计了图1装置①分液漏斗中的A物质是(填试剂名称).②利用中学常见的仪器,空白方框内补充完整实验装置.可选择的试剂有:A.稀NaOH溶液 B.无水氯化钙 C.稀硫酸 D.浓硫酸③假设实验过程中 MgCl2•6H2O 未水解,不用任何试剂用最简单的方法检验MgCl2•6H2O 是否完全转化为MgCl2.写出实验
2019-12-02
研究物质的合成或制备是有机化学、无机化学的重要任务之一.
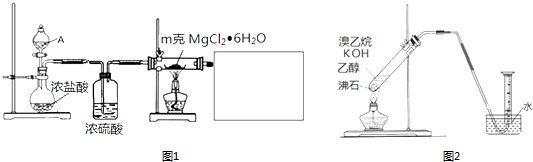
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了图1装置
①分液漏斗中的A物质是___(填试剂名称).
②利用中学常见的仪器,空白方框内补充完整实验装置___.
可选择的试剂有:A.稀NaOH溶液 B.无水氯化钙 C.稀硫酸 D.浓硫酸
③假设实验过程中 MgCl2•6H2O 未水解,不用任何试剂用最简单的方法检验MgCl2•6H2O 是否完全转化为MgCl2.写出实验方法___.
(2)实验室制备并收集纯净乙烯
①有的同学通过乙醇制备乙烯,写出相关化学方程式:___.
该实验除乙醇外,所需的试剂或用品(不包括仪器)有___、___、___.
②有的同学探究其它制备乙烯的方法,他设计了图2装置制备乙烯.实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体.
请分析气体产率很低的原因主要是___.
为增大气体产率,在右图装置的基础上,提出一点改进措施:___.
优质解答
(1)加热氯化镁晶体失去结晶水得到无水氯化镁,由于氯化镁易水解,应在HCl氛围中加热分解,A中液体为浓硫酸,与圆底烧瓶中浓盐酸混合,发生大量的热,利用HCl逸出,洗气瓶中浓硫酸干燥HCl,利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,注意防止倒吸,还要防止氢氧化钠溶液中水蒸气导致氯化镁水解,尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管(或盛放浓硫酸的洗气瓶);
①由上述分析可知,分液漏斗中的A物质是浓硫酸,故答案为:浓硫酸;
②利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,且防止倒吸,还要在尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管(或盛放浓硫酸的洗气瓶),防止氯化镁水解,需要补充完整实验装置为: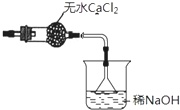 等,
等,
故答案为: 等;
等;
③实验过程中MgCl2▪6H2O未水解,mg晶体的物质的量为mol,完全分解得到氯化镁为mol×95g/mol=g,称量所得产物质量,若质量为g,说明MgCl2▪6H2O完全转化为MgCl2,否则未完全,
故答案为:称量所得产物质量,若质量为g,说明MgCl2▪6H2O完全转化为MgCl2,否则未完全;
(2)①乙醇在浓硫酸作用下发生消去反应生成乙烯,反应方程式为:CH3CH2OHCH2=CH2↑+H2O,
反应中会发生副反应,有二氧化碳、二氧化硫生成,用氢氧化钠溶液吸收除去二氧化碳、二氧化硫,液体加热需要防止暴沸,还需要加入沸石,除乙醇外,所需的试剂或用品(不包括仪器)有:浓硫酸、氢氧化钠溶液、沸石,
故答案为:CH3CH2OHCH2=CH2↑+H2O;浓硫酸、氢氧化钠溶液、沸石;
②方案中利用溴乙烷发生消去反应生成乙烯,利用图中装置制备乙烯,实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,说明生成乙烯很少,大量的溴乙烷挥发,
气体产率很低的原因主要是:加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等;
为增大气体产率,可以增加冷凝回流装置,有利于溴乙烷冷凝回流,可以利用水浴加热,便于控制温度等,减少溴乙烷挥发,
故答案为:加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等;增加冷凝回流装置等.
(1)加热氯化镁晶体失去结晶水得到无水氯化镁,由于氯化镁易水解,应在HCl氛围中加热分解,A中液体为浓硫酸,与圆底烧瓶中浓盐酸混合,发生大量的热,利用HCl逸出,洗气瓶中浓硫酸干燥HCl,利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,注意防止倒吸,还要防止氢氧化钠溶液中水蒸气导致氯化镁水解,尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管(或盛放浓硫酸的洗气瓶);
①由上述分析可知,分液漏斗中的A物质是浓硫酸,故答案为:浓硫酸;
②利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,且防止倒吸,还要在尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管(或盛放浓硫酸的洗气瓶),防止氯化镁水解,需要补充完整实验装置为: 等,
等,
故答案为: 等;
等;
③实验过程中MgCl2▪6H2O未水解,mg晶体的物质的量为mol,完全分解得到氯化镁为mol×95g/mol=g,称量所得产物质量,若质量为g,说明MgCl2▪6H2O完全转化为MgCl2,否则未完全,
故答案为:称量所得产物质量,若质量为g,说明MgCl2▪6H2O完全转化为MgCl2,否则未完全;
(2)①乙醇在浓硫酸作用下发生消去反应生成乙烯,反应方程式为:CH3CH2OHCH2=CH2↑+H2O,
反应中会发生副反应,有二氧化碳、二氧化硫生成,用氢氧化钠溶液吸收除去二氧化碳、二氧化硫,液体加热需要防止暴沸,还需要加入沸石,除乙醇外,所需的试剂或用品(不包括仪器)有:浓硫酸、氢氧化钠溶液、沸石,
故答案为:CH3CH2OHCH2=CH2↑+H2O;浓硫酸、氢氧化钠溶液、沸石;
②方案中利用溴乙烷发生消去反应生成乙烯,利用图中装置制备乙烯,实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,说明生成乙烯很少,大量的溴乙烷挥发,
气体产率很低的原因主要是:加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等;
为增大气体产率,可以增加冷凝回流装置,有利于溴乙烷冷凝回流,可以利用水浴加热,便于控制温度等,减少溴乙烷挥发,
故答案为:加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等;增加冷凝回流装置等.


 等,
等,