在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题:Ⅰ:(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2 (l)+H2O(l).①已知该反应的平衡常数K195℃”“=”或“
2019-04-19
在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题:
Ⅰ:(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2 (l)+H2O(l).
①已知该反应的平衡常数K195℃165℃,则该反应的△H___0(填“>”“=”或“<”).
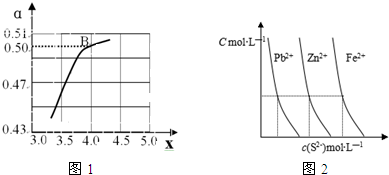
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
=x,如图1是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大的原因是___;B点处,NH3的体积分数为___%(保留小数点后一位).
③取一定量的NH3和CO2放在一个密闭真空容器中,在一定温度下反应达平衡,若在恒温、恒容下充入气体He,CO(NH2)2(l)的质量___(填“增加”、“减小”或“不变”).
Ⅱ:(1)某温度下,纯水中c(H+)=2.0×10-7mol/L,该温度下,0.9mol/L NaOH溶液与0.1mol/L HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=___.
(2)向100mL 0.10mol/L CH3COOH的溶液中加入0.010mol CH3COONa固体,溶液pH增大.已知该混合溶液中c(Na+)3COO-),则c(CH3COOH)___c(CH3COO-)(填“>”、“<”或“=”)
Ⅲ:(1)如图2为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是___(填化学式).
(2)向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀最终会转化为___(填化学式)沉淀.
Ⅰ:(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2 (l)+H2O(l).
①已知该反应的平衡常数K195℃
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
| n(NH3) |
| n(CO2) |
③取一定量的NH3和CO2放在一个密闭真空容器中,在一定温度下反应达平衡,若在恒温、恒容下充入气体He,CO(NH2)2(l)的质量___(填“增加”、“减小”或“不变”).
Ⅱ:(1)某温度下,纯水中c(H+)=2.0×10-7mol/L,该温度下,0.9mol/L NaOH溶液与0.1mol/L HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=___.
(2)向100mL 0.10mol/L CH3COOH的溶液中加入0.010mol CH3COONa固体,溶液pH增大.已知该混合溶液中c(Na+)
Ⅲ:(1)如图2为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是___(填化学式).
(2)向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀最终会转化为___(填化学式)沉淀.
