优质解答
由元素周期表的位置,可知a是H,b是He,c是Na,d是Al,e是C,f是N,g是O,h是Si,i为S,j为Cl.
(1)稀有气体He原子最外层为稳定结构,其化学性质最不活泼,故答案为:氦;
(2)Si原子核外电子数为14,有3个电子层,各层电子数为2、8、4,原子结构示意图为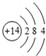 ;工业上用碳与二氧化硅反应制备Si,反应方程式为:2C+SiO2
;工业上用碳与二氧化硅反应制备Si,反应方程式为:2C+SiO2
Si+2CO↑,
故答案为: ;2C+SiO2
;2C+SiO2
Si+2CO↑;
(3)电子层结构相同的离子,核电荷数越强离子半径越小,故离子半径:O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(4)非金属性g>e,非金属性越强,对应氢化物越稳定,故氢化物稳定性g>e,故答案为:>;
(5)c元素最高价氧化物的水化物为NaOH,含有离子键、共价键,氢氧化钠能与二氧化硅反应生成硅酸钠,反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,硅酸钠是无机矿物胶,使瓶塞与瓶口粘在一起,NaOH不能储存在带玻璃塞的试剂瓶中,
故答案为:离子键、共价键;SiO2+2NaOH=Na2SiO3+H2O. 由元素周期表的位置,可知a是H,b是He,c是Na,d是Al,e是C,f是N,g是O,h是Si,i为S,j为Cl.
(1)稀有气体He原子最外层为稳定结构,其化学性质最不活泼,故答案为:氦;
(2)Si原子核外电子数为14,有3个电子层,各层电子数为2、8、4,原子结构示意图为 ;工业上用碳与二氧化硅反应制备Si,反应方程式为:2C+SiO2
;工业上用碳与二氧化硅反应制备Si,反应方程式为:2C+SiO2
Si+2CO↑,
故答案为: ;2C+SiO2
;2C+SiO2
Si+2CO↑;
(3)电子层结构相同的离子,核电荷数越强离子半径越小,故离子半径:O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(4)非金属性g>e,非金属性越强,对应氢化物越稳定,故氢化物稳定性g>e,故答案为:>;
(5)c元素最高价氧化物的水化物为NaOH,含有离子键、共价键,氢氧化钠能与二氧化硅反应生成硅酸钠,反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,硅酸钠是无机矿物胶,使瓶塞与瓶口粘在一起,NaOH不能储存在带玻璃塞的试剂瓶中,
故答案为:离子键、共价键;SiO2+2NaOH=Na2SiO3+H2O.
(1)稀有气体He原子最外层为稳定结构,其化学性质最不活泼,故答案为:氦;
(2)Si原子核外电子数为14,有3个电子层,各层电子数为2、8、4,原子结构示意图为
 ;工业上用碳与二氧化硅反应制备Si,反应方程式为:2C+SiO2
;工业上用碳与二氧化硅反应制备Si,反应方程式为:2C+SiO2
| ||
故答案为:
 ;2C+SiO2
;2C+SiO2
| ||
(3)电子层结构相同的离子,核电荷数越强离子半径越小,故离子半径:O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(4)非金属性g>e,非金属性越强,对应氢化物越稳定,故氢化物稳定性g>e,故答案为:>;
(5)c元素最高价氧化物的水化物为NaOH,含有离子键、共价键,氢氧化钠能与二氧化硅反应生成硅酸钠,反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,硅酸钠是无机矿物胶,使瓶塞与瓶口粘在一起,NaOH不能储存在带玻璃塞的试剂瓶中,
故答案为:离子键、共价键;SiO2+2NaOH=Na2SiO3+H2O. 由元素周期表的位置,可知a是H,b是He,c是Na,d是Al,e是C,f是N,g是O,h是Si,i为S,j为Cl.
(1)稀有气体He原子最外层为稳定结构,其化学性质最不活泼,故答案为:氦;
(2)Si原子核外电子数为14,有3个电子层,各层电子数为2、8、4,原子结构示意图为
 ;工业上用碳与二氧化硅反应制备Si,反应方程式为:2C+SiO2
;工业上用碳与二氧化硅反应制备Si,反应方程式为:2C+SiO2
| ||
故答案为:
 ;2C+SiO2
;2C+SiO2
| ||
(3)电子层结构相同的离子,核电荷数越强离子半径越小,故离子半径:O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(4)非金属性g>e,非金属性越强,对应氢化物越稳定,故氢化物稳定性g>e,故答案为:>;
(5)c元素最高价氧化物的水化物为NaOH,含有离子键、共价键,氢氧化钠能与二氧化硅反应生成硅酸钠,反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,硅酸钠是无机矿物胶,使瓶塞与瓶口粘在一起,NaOH不能储存在带玻璃塞的试剂瓶中,
故答案为:离子键、共价键;SiO2+2NaOH=Na2SiO3+H2O.