元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系. (1)第二周期元素碳、氮、氧的电负性从大到小顺序为(用元素符号表示).(2)第四周期元素砷、硒、溴的第一电离能从大到小顺序为(用元素符号表示).(3)第 IIIA族元素原子具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质.①[B(OH)4]-中B的原子杂化类型为;②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为.(4)过渡区元素铜的离子是人体内多种酶的辅因
2019-06-25
元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.
(1)第二周期元素碳、氮、氧的电负性从大到小顺序为___(用元素符号表示).
(2)第四周期元素砷、硒、溴的第一电离能从大到小顺序为___
(用元素符号表示).
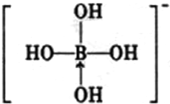
(3)第 IIIA族元素原子具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质.
①[B(OH)4]-中B的原子杂化类型为___;
②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为___.
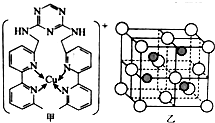
(4)过渡区元素铜的离子是人体内多种酶的辅因子.某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子:
①写出Cu(Ⅰ)的电子排布式___;
②该离子中含有化学键的类型有___(选填字母).
A.极性键 B.离子键 C.非极性键 D.配位键
③向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的晶胞结构如图乙所示.写出该反应的离子方程式___.

(1)第二周期元素碳、氮、氧的电负性从大到小顺序为___(用元素符号表示).
(2)第四周期元素砷、硒、溴的第一电离能从大到小顺序为___
(用元素符号表示).
(3)第 IIIA族元素原子具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质.
①[B(OH)4]-中B的原子杂化类型为___;
②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为___.
(4)过渡区元素铜的离子是人体内多种酶的辅因子.某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子:
①写出Cu(Ⅰ)的电子排布式___;
②该离子中含有化学键的类型有___(选填字母).
A.极性键 B.离子键 C.非极性键 D.配位键
③向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的晶胞结构如图乙所示.写出该反应的离子方程式___.
 ;故答案为:
;故答案为: