二氯化二硫(S 2 Cl 2 )在工业上用于橡胶的硫化.为了在实验室合成S 2 Cl 2 ,某化学研究性小组查阅了有关资料,得到如下信息:①在110℃-140℃时,将干燥的氯气与硫反应可得到S 2 Cl 2 的粗产品.②有关物质的部分性质如下表: 物质 熔点/℃ 沸点/℃ 化学性质 S 112.8 44.6 略 S 2 Cl 2 -77 137 S 2 Cl 2 、遇水生成HCl、SO 2 、S且温度过高容易分解(300度以上完全分解) SCl 2 -121
2019-12-02
| 二氯化二硫(S 2 Cl 2 )在工业上用于橡胶的硫化.为了在实验室合成S 2 Cl 2 ,某化学研究性小组查阅了有关资料,得到如下信息: ①在110℃-140℃时,将干燥的氯气与硫反应可得到S 2 Cl 2 的粗产品. ②有关物质的部分性质如下表:
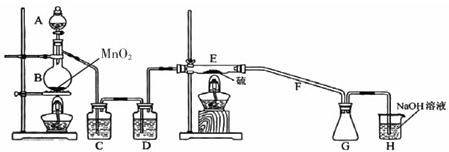 (1)仪器A的名称分别为______. B中发生反应的离子方程式为______. C中的试剂名称是______;仪器D的作用是______. (2)上图中装置不够完善,请你提出改进意见______; (3)利用改进后的正确装置进行实验,请回答下列问题 ①E中反应的化学方程式为______. ②如果在加热E时温度过高,对实验结果的影响是______. ③S 2 Cl 2 粗品中可能混有的杂质是SCl 2 、Cl 2 、S,为了提高S 2 Cl 2 的纯度,关键的操作是控制好温度和______. |