酯化反应是中学有机化学反应中重要的反应之一.如图为乙酸乙酯的制备装置图.a试管中装有适当过量的无水乙醇、2mL浓硫酸和2mL冰醋酸,小心均匀加热(避免副反应)至充分反应.请回答:(1)写出反应的化学方程式;(2)b试管中装的液体通常是,实验时往往在b试管中可以看到少量气泡,写出与此现象对应的离子方程式.(3)甲同学为了研究该反应机理使用了2H作同位素示踪原子.你认为合理吗?为什么?;乙同学采用“CH3CH218OH”做该实验,结果含18O原子的产物的结构简式为,乙酸分子中被取代的原子团的电子式为;(4)浓
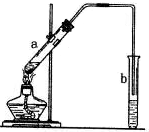 酯化反应是中学有机化学反应中重要的反应之一.如图为乙酸乙酯的制备装置图.a试管中装有适当过量的无水乙醇、2mL浓硫酸和2mL冰醋酸,小心均匀加热(避免副反应)至充分反应.请回答:
酯化反应是中学有机化学反应中重要的反应之一.如图为乙酸乙酯的制备装置图.a试管中装有适当过量的无水乙醇、2mL浓硫酸和2mL冰醋酸,小心均匀加热(避免副反应)至充分反应.请回答:
(1)写出反应的化学方程式______;
(2)b试管中装的液体通常是______,实验时往往在b试管中可以看到少量气泡,写出与此现象对应的离子方程式______.
(3)甲同学为了研究该反应机理使用了2H作同位素示踪原子.你认为合理吗?为什么?______;乙同学采用“CH3CH218OH”做该实验,结果含18O原子的产物的结构简式为______,乙酸分子中被取代的原子团的电子式为______;
(4)浓硫酸在该反应中的作用是催化剂和______剂,以此加快反应速率和______(用化学平衡知识答题).
2019-11-27
 酯化反应是中学有机化学反应中重要的反应之一.如图为乙酸乙酯的制备装置图.a试管中装有适当过量的无水乙醇、2mL浓硫酸和2mL冰醋酸,小心均匀加热(避免副反应)至充分反应.请回答:
酯化反应是中学有机化学反应中重要的反应之一.如图为乙酸乙酯的制备装置图.a试管中装有适当过量的无水乙醇、2mL浓硫酸和2mL冰醋酸,小心均匀加热(避免副反应)至充分反应.请回答:(1)写出反应的化学方程式______;
(2)b试管中装的液体通常是______,实验时往往在b试管中可以看到少量气泡,写出与此现象对应的离子方程式______.
(3)甲同学为了研究该反应机理使用了2H作同位素示踪原子.你认为合理吗?为什么?______;乙同学采用“CH3CH218OH”做该实验,结果含18O原子的产物的结构简式为______,乙酸分子中被取代的原子团的电子式为______;
(4)浓硫酸在该反应中的作用是催化剂和______剂,以此加快反应速率和______(用化学平衡知识答题).
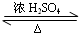 CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,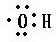 ,
,