(2007•淄博三模)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是.(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式.(3)将
2019-04-29
(2007•淄博三模)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是______.
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式______.
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为______.
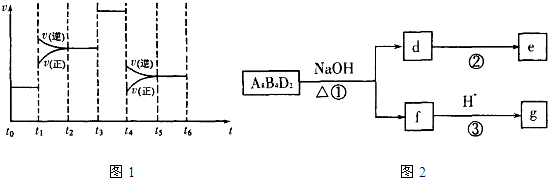
(4)化学反应3A2(g)+C2(g)⇌2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图1表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是______.温度为T℃时,将4a mol A2和2a mol C2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数
(5)化合物A8B4D2有如图2转化关系.其中,g是常用调味品的主要成分.写出反应①的化学方程式CH
3COOC
2H
5+NaOH
CH
3COONa+CH
3CH
2OH
CH
3COOC
2H
5+NaOH
CH
3COONa+CH
3CH
2OH
设计实验方案完成d→e的转化______
优质解答
A、B、C、D、E五种短周期元素,原子序数依次增大.A元素的原子半径最小,则A为氢元素;B元素原子的最外层电子数是内层电子数的2倍,则B有2个电子层,最外层电子数为4,则B为碳元素;C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,则C为氮元素、X为硝酸、Y为硝酸铵;A、E同主族,E的原子序数大于碳元素,则E为Na元素;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,则D为O氧元素,
(1)常温下,硝酸溶液中水电离中氢离子浓度等于溶液中氢氧根离子浓度为mol/L=10-9mol/L.硝酸铵溶液中氢离子为水电离产生的,氢离子浓度为10-5mol/L,故两溶液中由水电离出的H+浓度之比为10-9mol/L:10-5mol/L=10-4:1,
故答案为:10-4:1;
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解,该化合物为NaHCO3,少量NaHCO3溶液与足量的Ba(OH)2溶液反应生成碳酸钡、碳酸钠与是,反应的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O,
故答案为:Ba2++HCO3-+OH-═BaCO3↓+H2O;
(3)将铝片和镁片用导线相连,插入NaOH的稀溶液中构成原电池,铝与氢氧化钠溶液反应,Mg不与氢氧化钠溶液反应,故Al为负极,电极反应式为Al+4OH-═AlO2-+2H2O+3e-,
故答案为:Al+4OH-═AlO2-+2H2O+3e-;
(4)t0~t1,正逆反应速率相等,处于平衡状态;t1~t2,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆反应方向移动,导致CA3的含量降低;t2~t3,正逆反应速率相等,处于平衡状态,CA3的含量不变;t3~t4,正逆反应速率都同等程度的增大平衡不移动,CA3的含量不变;t4~t5,正逆反应速率都降低,但逆反应速率大于正反应速率,导致平衡向逆反应方向移动,CA3的含量降低;t5~t6,正逆反应速率相等,平衡不移动,CA3的含量不变,所以平衡混合物中CA3的含量最高的一段时间是t0~t1.
3A2(g)+C2(g)⇌2CA3(g)
开始(mol/L):4a 2a 0
变化(mol/L):3a a 2a
平衡(mol/L):a a 2a
故该温度平衡常数k==
故答案为:t0~t1;;
(5)化合物H8C4O2在碱性条件下得到f,f酸化得到g,g是常用调味品的主要成分,化合物为CH3COOC2H5,f为乙酸钠,反应①的化学方程式为CH3COOC2H5+NaOHCH3COONa+CH3CH2OH.
d为乙醇,乙醇催化氧化可以得到乙醛,方案为:取一根光洁铜丝绕成螺旋状,放在酒精灯外焰加热,然后伸入d中,反复几次,观察到铜丝由红→黑→红,并闻到液体有刺激性气味,
故答案为:CH3COOC2H5+NaOHCH3COONa+CH3CH2OH;取一根光洁铜丝绕成螺旋状,放在酒精灯外焰加热,然后伸入d中,反复几次,观察到铜丝由红→黑→红,并闻到液体有刺激性气味.
A、B、C、D、E五种短周期元素,原子序数依次增大.A元素的原子半径最小,则A为氢元素;B元素原子的最外层电子数是内层电子数的2倍,则B有2个电子层,最外层电子数为4,则B为碳元素;C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,则C为氮元素、X为硝酸、Y为硝酸铵;A、E同主族,E的原子序数大于碳元素,则E为Na元素;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,则D为O氧元素,
(1)常温下,硝酸溶液中水电离中氢离子浓度等于溶液中氢氧根离子浓度为mol/L=10-9mol/L.硝酸铵溶液中氢离子为水电离产生的,氢离子浓度为10-5mol/L,故两溶液中由水电离出的H+浓度之比为10-9mol/L:10-5mol/L=10-4:1,
故答案为:10-4:1;
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解,该化合物为NaHCO3,少量NaHCO3溶液与足量的Ba(OH)2溶液反应生成碳酸钡、碳酸钠与是,反应的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O,
故答案为:Ba2++HCO3-+OH-═BaCO3↓+H2O;
(3)将铝片和镁片用导线相连,插入NaOH的稀溶液中构成原电池,铝与氢氧化钠溶液反应,Mg不与氢氧化钠溶液反应,故Al为负极,电极反应式为Al+4OH-═AlO2-+2H2O+3e-,
故答案为:Al+4OH-═AlO2-+2H2O+3e-;
(4)t0~t1,正逆反应速率相等,处于平衡状态;t1~t2,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆反应方向移动,导致CA3的含量降低;t2~t3,正逆反应速率相等,处于平衡状态,CA3的含量不变;t3~t4,正逆反应速率都同等程度的增大平衡不移动,CA3的含量不变;t4~t5,正逆反应速率都降低,但逆反应速率大于正反应速率,导致平衡向逆反应方向移动,CA3的含量降低;t5~t6,正逆反应速率相等,平衡不移动,CA3的含量不变,所以平衡混合物中CA3的含量最高的一段时间是t0~t1.
3A2(g)+C2(g)⇌2CA3(g)
开始(mol/L):4a 2a 0
变化(mol/L):3a a 2a
平衡(mol/L):a a 2a
故该温度平衡常数k==
故答案为:t0~t1;;
(5)化合物H8C4O2在碱性条件下得到f,f酸化得到g,g是常用调味品的主要成分,化合物为CH3COOC2H5,f为乙酸钠,反应①的化学方程式为CH3COOC2H5+NaOHCH3COONa+CH3CH2OH.
d为乙醇,乙醇催化氧化可以得到乙醛,方案为:取一根光洁铜丝绕成螺旋状,放在酒精灯外焰加热,然后伸入d中,反复几次,观察到铜丝由红→黑→红,并闻到液体有刺激性气味,
故答案为:CH3COOC2H5+NaOHCH3COONa+CH3CH2OH;取一根光洁铜丝绕成螺旋状,放在酒精灯外焰加热,然后伸入d中,反复几次,观察到铜丝由红→黑→红,并闻到液体有刺激性气味.

