氨是化学实验室及化工生产中的重要物质,应用广泛.(1)已知25℃时:N2(g)+O2(g)⇌2NO(g)△H=+183kJ/mol2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-1164.4kJ/mol则 N2(g)+3H2(g)⇌2NH3(g)△H=(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表: N2 H2 NH3 投料Ⅰ 1.0m
2019-06-24
氨是化学实验室及化工生产中的重要物质,应用广泛.
(1)已知25℃时:N2(g)+O2(g)⇌2NO(g)△H=+183kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol
4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-1164.4kJ/mol
则 N2(g)+3H2(g)⇌2NH3(g)△H=___
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为___.
②按投料Ⅱ进行反应,起始时反应进行的方向为___(填“正向”或“逆向”).
③若升高温度,则合成氨反应的化学平衡常数___(填“变大”、“变小”或“不变”).
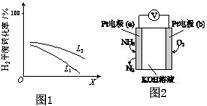
④L(L1、L2)、X可分别代表压强或温度.如图1表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系.
ⅰX代表的物理量是___.
ⅱ判断L1、L2的大小关系,L1___L2.(填“>”“<”或“=”)
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意如图2:
①电极b上发生的是___反应(填“氧化”或“还原”)
②写出电极a的电极反应式:___.
(1)已知25℃时:N2(g)+O2(g)⇌2NO(g)△H=+183kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol
4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-1164.4kJ/mol
则 N2(g)+3H2(g)⇌2NH3(g)△H=___
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
| N2 | H2 | NH3 | |
| 投料Ⅰ | 1.0mol/L | 3.0mol/L | 0 |
| 投料Ⅱ | 0.5mol/L | 1.5mol/L | 1.0mol/L |
②按投料Ⅱ进行反应,起始时反应进行的方向为___(填“正向”或“逆向”).
③若升高温度,则合成氨反应的化学平衡常数___(填“变大”、“变小”或“不变”).
④L(L1、L2)、X可分别代表压强或温度.如图1表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系.
ⅰX代表的物理量是___.
ⅱ判断L1、L2的大小关系,L1___L2.(填“>”“<”或“=”)
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意如图2:
①电极b上发生的是___反应(填“氧化”或“还原”)
②写出电极a的电极反应式:___.
