(2014•洛阳模拟)氨气是中学化学中常见的气体,其用途广泛.(1)实验室制取氨气的化学方程式是2NH4Cl+Ca(OH)2 △ . 2NH3↑+CaCl2+2H2O2NH4Cl+Ca(OH)2 △ . 2NH3↑+CaCl2+2H2O.(2)工业上氨气可以由氢气和氮气合成.①该反应的热化学方程式是.②简述一种检查氨气是否泄露可采用的化学方法:.(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反
2019-06-22
(2014•洛阳模拟)氨气是中学化学中常见的气体,其用途广泛.
(1)实验室制取氨气的化学方程式是2NH
4Cl+Ca(OH)
2 2NH
3↑+CaCl
2+2H
2O
2NH
4Cl+Ca(OH)
2 2NH
3↑+CaCl
2+2H
2O
(2)工业上氨气可以由氢气和氮气合成.
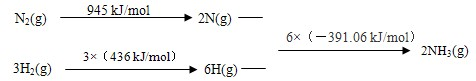
①该反应的热化学方程式是______.
②简述一种检查氨气是否泄露可采用的化学方法:______.
(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.

①曲线a对应的温度是______.
②关于工业合成氨的反应,下列叙述正确的是______(填字母).
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③M点对应的H2转化率是______.
(4)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气.
①当氨水中所含氨的物质的量为3mol,吸收标准状况下44.8L SO2时,溶液中的溶质为______.
②(NH4)2SO3显碱性,用化学平衡原理解释______.
③NH4HSO3显酸性.用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是______(填字母).
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)>c(H+)=c(OH-)
c.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
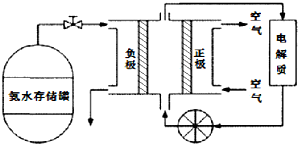
①氨气燃料电池的电解质溶液最好选择______(填“酸性”、“碱性”或“中性”)溶液.
②空气在进入电池装置前需要通过过滤器除去的气体是______.
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是______,正极的电极反应方是______.
优质解答
(1)实验室用硫化铵和氢氧化钙固体加热制取氨气,反应方程式为:2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O;
(2)①△H=反应物键能和-生成物键能和=945KJ/mol+3×436KJ/mol-6×391.06KJ/mol=-93.36 kJ/mol,所以,其热化学方程式为:N2(g)+3H2(g)  2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)
2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)  2NH3(g)△H=-93.36 kJ/mol;
2NH3(g)△H=-93.36 kJ/mol;
②氨气和HCl反应产生白烟,并且显碱性,所以,检查氨气是否泄露可采用的化学方法有:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露.(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露,
故答案为:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露.(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露;
(3)①合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是200℃,故答案为:200℃;
②A、减小生成物浓度平衡正向移动,及时分离出NH3可以提高H2的平衡转化率,故A正确;
B、催化剂不影响平衡移动,加催化剂能加快反应速率但不能提高H2的平衡转化率,故B错误;
C、K只受温度影响,该反应温度升高时K值减小,b是400℃,c是600℃,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
故选:AC;
③N2(g)+3H2(g)  2NH3(g)
2NH3(g)
反应前(mol) 1 3 0
反应了(mol) x 3x 2x
平衡时(mol) 1-x 3-3x 2x
据题意M点时:×100%=60%
x=,
则氢气的转化率为:×100%=75%,故答案为:75%;
(4))①氨的物质的量为3mol,吸收标准状况下44.8L SO2时.N原子3mol,S原子2mol,据原子守恒,在(NH4)2SO3中,其原子个数比N:S=2:1,在中,NH4HSO3,其原子个数比N:S=1:1,所以,生成物有(NH4)2SO3和NH4HSO3,故答案为:(NH4)2SO3和NH4HSO3;
②(NH4)2SO3溶液中,铵根和亚硫酸根都会水解,(NH4)2SO3显碱性说明,NH4++H2O NH3•H2O+H+SO32-+H2O
NH3•H2O+H+SO32-+H2O HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性,
HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性,
故答案为:NH4++H2O NH3•H2O+H+SO32-+H2O
NH3•H2O+H+SO32-+H2O HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性;
HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性;
③据电荷守恒有:c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性,则,c(H+)=c(OH-),故a正确,b正确,c错误,故选:ab;
(5)①氨气是碱性气体,所以电解液最好选择碱性的,故答案为:碱性;
②空气中的CO2能和氨水反应,所以,滤去的气体是CO2,故答案为:CO2;
③生成的无毒气体时N2,据此书写化学方程式为:4NH3+3O2=2N2+6H2O,故答案为:4NH3+3O2=2N2+6H2O;
正极发生氧化反应,氧气在正极反应,注意时碱性环境,所以,正极的电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-.
(1)实验室用硫化铵和氢氧化钙固体加热制取氨气,反应方程式为:2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O;
(2)①△H=反应物键能和-生成物键能和=945KJ/mol+3×436KJ/mol-6×391.06KJ/mol=-93.36 kJ/mol,所以,其热化学方程式为:N2(g)+3H2(g)  2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)
2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)  2NH3(g)△H=-93.36 kJ/mol;
2NH3(g)△H=-93.36 kJ/mol;
②氨气和HCl反应产生白烟,并且显碱性,所以,检查氨气是否泄露可采用的化学方法有:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露.(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露,
故答案为:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露.(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露;
(3)①合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是200℃,故答案为:200℃;
②A、减小生成物浓度平衡正向移动,及时分离出NH3可以提高H2的平衡转化率,故A正确;
B、催化剂不影响平衡移动,加催化剂能加快反应速率但不能提高H2的平衡转化率,故B错误;
C、K只受温度影响,该反应温度升高时K值减小,b是400℃,c是600℃,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
故选:AC;
③N2(g)+3H2(g)  2NH3(g)
2NH3(g)
反应前(mol) 1 3 0
反应了(mol) x 3x 2x
平衡时(mol) 1-x 3-3x 2x
据题意M点时:×100%=60%
x=,
则氢气的转化率为:×100%=75%,故答案为:75%;
(4))①氨的物质的量为3mol,吸收标准状况下44.8L SO2时.N原子3mol,S原子2mol,据原子守恒,在(NH4)2SO3中,其原子个数比N:S=2:1,在中,NH4HSO3,其原子个数比N:S=1:1,所以,生成物有(NH4)2SO3和NH4HSO3,故答案为:(NH4)2SO3和NH4HSO3;
②(NH4)2SO3溶液中,铵根和亚硫酸根都会水解,(NH4)2SO3显碱性说明,NH4++H2O NH3•H2O+H+SO32-+H2O
NH3•H2O+H+SO32-+H2O HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性,
HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性,
故答案为:NH4++H2O NH3•H2O+H+SO32-+H2O
NH3•H2O+H+SO32-+H2O HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性;
HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性;
③据电荷守恒有:c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性,则,c(H+)=c(OH-),故a正确,b正确,c错误,故选:ab;
(5)①氨气是碱性气体,所以电解液最好选择碱性的,故答案为:碱性;
②空气中的CO2能和氨水反应,所以,滤去的气体是CO2,故答案为:CO2;
③生成的无毒气体时N2,据此书写化学方程式为:4NH3+3O2=2N2+6H2O,故答案为:4NH3+3O2=2N2+6H2O;
正极发生氧化反应,氧气在正极反应,注意时碱性环境,所以,正极的电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-.
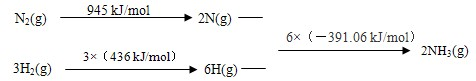


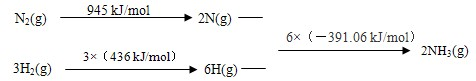


 2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)
2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)  NH3•H2O+H+SO32-+H2O
NH3•H2O+H+SO32-+H2O HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性,
HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性,