一位同学模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠.实验装置如图所示.烧瓶(甲)中所盛的固体原料是,洗气瓶(乙)中所盛试剂是;烧瓶(丁)中稀硫酸的作用是;实验结束后,通过操作分离出NaHCO3晶体.(1)将(丙)中NaHCO3晶体分离后,母液中主要含有四种离子(不计H+、OH-).它们是、、、.若在母液中加入消石灰,溶液中新生成的物质可能有(填写化学式).(2)单独将CO2一种气体通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的性.(3)将所得NaHCO3灼烧后得到碳
2019-04-09
一位同学模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠.实验装置如图所示.
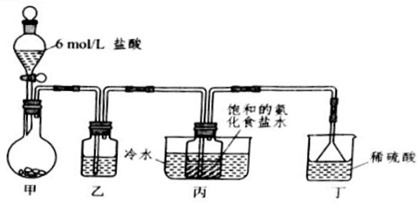
烧瓶(甲)中所盛的固体原料是___,洗气瓶(乙)中所盛试剂是___;
烧瓶(丁)中稀硫酸的作用是___;实验结束后,通过___操作分离出NaHCO3晶体.
(1)将(丙)中NaHCO3晶体分离后,母液中主要含有四种离子(不计H+、OH-).它们是
___、___、___、___.若在母液中加入消石灰,溶液中新生成的物质可能有(填写化学式)___.
(2)单独将CO2一种气体通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的___性.
(3)将所得NaHCO3灼烧后得到碳酸钠.不做溶解操作、不使用带导管的实验装置.证明NaHCO3已完全分解的简便方法是___;验证产品中是否混有NaCl的基本方法是___.
(4)某纯碱样品中含有少量NaHCO3,欲知NaHCO3的质量分数,可将样品灼烧,并吸收称重分解所得CO2的质量.相关装置中先后使用的两种干燥剂(或吸收剂)是___(先)、___(后).
(5)已知某碱样品中只含NaCl一种杂质,还需定量测定其纯度,比较精准的一种方法是将样品配成溶液后用标准酸溶液进行滴定.
①若以甲基橙为指示剂,在滴定过程中其颜色由___变成___.
②将0.100mol/L 标准硫酸溶液装入滴定管;称取纯碱样品,用烧杯和100mL___瓶配成待测液.
③用___管取出其中10.00mL 装入___瓶;至滴定终点,用去标准硫酸溶液15.00mL.
④100mL 待测液中Na2CO3的质量为___g.
优质解答
模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠.需制取纯净的二氧化碳,甲装置:用盐酸和碳酸钙反应CaCO3+2HCl═CaCl2+H2O+CO2↑,制取二氧化碳,利用盐酸制取二氧化碳时,因盐酸易挥发,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,乙装置:除去二氧化碳中的氯化氢,丙装置:将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠,实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,稀硫酸的作用是吸收末反应的NH3,丁装置:吸收未反应完的NH3,并能防止倒吸,固液分离常采用过滤的方法,实验结束后,通过过滤操作分离出NaHCO3晶体,
故答案为:碳酸钙;饱和碳酸氢钠;吸收未反应完的NH3;过滤.
(1)模仿氨碱法制备固体碳酸氢钠发生反应:NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl,所以将(丙)中NaHCO3晶体分离后,母液中主要含有四种离子(不计H+、OH-).它们是Na+、HCO3-、NH4+、Cl-,若在母液中加入消石灰,发生反应NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH,溶液中新生成的物质可能有CaCO3,
故答案为:Na+、HCO3-、NH4+、Cl-;CaCO3;
(2)氨气极易溶于水,氨水显碱性,二氧化碳为酸性气体,单独将CO2一种气体通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的碱性,
故答案为:碱;
(3)碳酸氢钠受热易分 2NaHCO3Na2CO3+CO2↑+H2O,将所得NaHCO3灼烧后得到碳酸钠.不做溶解操作、不使用带导管的实验装置.证明NaHCO3已完全分解,可继续加热,质量不再发生变化则说明已完全分解(恒重操作),产品中若混有NaCl,可通过检验氯离子进行检验,方法为:取样,先加足量硝酸酸化,再加入AgNO3溶液,有白色沉淀则证明混有NaCl,
故答案为:继续加热,质量不再发生变化则说明已完全分解(恒重操作);取样,先加足量硝酸酸化,再加入AgNO3溶液,有白色沉淀则证明混有NaCl;
(4)欲知NaHCO3的质量分数,可将样品灼烧,碳酸氢钠受热易分解生成碳酸钠固体、二氧化碳气体、水,因碱石灰既能吸收水蒸气又能吸收二氧化碳,所以需先用浓硫酸吸收水蒸气,再用碱石灰吸收二氧化碳,并称重所得CO2的质量,
故答案为:浓硫酸;碱石灰;
(5)①酸滴定碱溶液,锥形瓶中为碱,以甲基橙为指示剂,滴定前为黄色,达到滴定终点时颜色变化为由黄色变为橙色,半分内不立即变回黄色,锥形瓶中发生反应的离子方程式为H++OH-=H2O,
故答案为:黄色;橙色;
②配制待测液的步骤有:计算、称量、溶解、转移、洗涤、定容、摇匀等,配制待测液使用的仪器有:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,称取纯碱样品,还需用用烧杯和100mL容量瓶配成待测液,
故答案为:容量;
③取出其中10.00mL,其体积精确到0.00mL,需用滴定管,用滴定管取出其中10.00mL 装入锥形瓶中,
故答案为:滴定;锥形;
④10mL 待测液中,0.100mol/L 标准硫酸溶液滴定,至滴定终点,用去标准硫酸溶液15.00mL,硫酸的物质的量为n(H2SO4)=CV=0.100mol/L×15.00mL=1.5×10-3mol,Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,n(Na2CO3)=1.5×10-3mol,Na2CO3的质量为m=nM=1.5×10-3mol×106g/mol=0.159g,则100mL 待测液中Na2CO3的质量为1.59g,
故答案为:1.59.
模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠.需制取纯净的二氧化碳,甲装置:用盐酸和碳酸钙反应CaCO3+2HCl═CaCl2+H2O+CO2↑,制取二氧化碳,利用盐酸制取二氧化碳时,因盐酸易挥发,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,乙装置:除去二氧化碳中的氯化氢,丙装置:将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠,实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,稀硫酸的作用是吸收末反应的NH3,丁装置:吸收未反应完的NH3,并能防止倒吸,固液分离常采用过滤的方法,实验结束后,通过过滤操作分离出NaHCO3晶体,
故答案为:碳酸钙;饱和碳酸氢钠;吸收未反应完的NH3;过滤.
(1)模仿氨碱法制备固体碳酸氢钠发生反应:NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl,所以将(丙)中NaHCO3晶体分离后,母液中主要含有四种离子(不计H+、OH-).它们是Na+、HCO3-、NH4+、Cl-,若在母液中加入消石灰,发生反应NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH,溶液中新生成的物质可能有CaCO3,
故答案为:Na+、HCO3-、NH4+、Cl-;CaCO3;
(2)氨气极易溶于水,氨水显碱性,二氧化碳为酸性气体,单独将CO2一种气体通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的碱性,
故答案为:碱;
(3)碳酸氢钠受热易分 2NaHCO3Na2CO3+CO2↑+H2O,将所得NaHCO3灼烧后得到碳酸钠.不做溶解操作、不使用带导管的实验装置.证明NaHCO3已完全分解,可继续加热,质量不再发生变化则说明已完全分解(恒重操作),产品中若混有NaCl,可通过检验氯离子进行检验,方法为:取样,先加足量硝酸酸化,再加入AgNO3溶液,有白色沉淀则证明混有NaCl,
故答案为:继续加热,质量不再发生变化则说明已完全分解(恒重操作);取样,先加足量硝酸酸化,再加入AgNO3溶液,有白色沉淀则证明混有NaCl;
(4)欲知NaHCO3的质量分数,可将样品灼烧,碳酸氢钠受热易分解生成碳酸钠固体、二氧化碳气体、水,因碱石灰既能吸收水蒸气又能吸收二氧化碳,所以需先用浓硫酸吸收水蒸气,再用碱石灰吸收二氧化碳,并称重所得CO2的质量,
故答案为:浓硫酸;碱石灰;
(5)①酸滴定碱溶液,锥形瓶中为碱,以甲基橙为指示剂,滴定前为黄色,达到滴定终点时颜色变化为由黄色变为橙色,半分内不立即变回黄色,锥形瓶中发生反应的离子方程式为H++OH-=H2O,
故答案为:黄色;橙色;
②配制待测液的步骤有:计算、称量、溶解、转移、洗涤、定容、摇匀等,配制待测液使用的仪器有:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,称取纯碱样品,还需用用烧杯和100mL容量瓶配成待测液,
故答案为:容量;
③取出其中10.00mL,其体积精确到0.00mL,需用滴定管,用滴定管取出其中10.00mL 装入锥形瓶中,
故答案为:滴定;锥形;
④10mL 待测液中,0.100mol/L 标准硫酸溶液滴定,至滴定终点,用去标准硫酸溶液15.00mL,硫酸的物质的量为n(H2SO4)=CV=0.100mol/L×15.00mL=1.5×10-3mol,Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,n(Na2CO3)=1.5×10-3mol,Na2CO3的质量为m=nM=1.5×10-3mol×106g/mol=0.159g,则100mL 待测液中Na2CO3的质量为1.59g,
故答案为:1.59.

