节能减排是当下环境保护的重点. (1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO (g)+H2O(g)⇌CO2(g)+H2(g),△H<0800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0. H2O CO CO2 H2 n/mol 0.20 0.20 0 0 ①从起始经过5min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)=;
2019-04-27
节能减排是当下环境保护的重点.
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反
应:CO (g)+H2O(g)⇌CO2(g)+H2(g),△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
①从起始经过5min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)=___;平衡时,容器中CO的转化率为___.
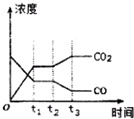
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是___.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:
CO(g)+l/2O2(g)⇌CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为___mol/L(请保留两位有效数字).
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为___mol/L.

(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反
应:CO (g)+H2O(g)⇌CO2(g)+H2(g),△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是___.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:
CO(g)+l/2O2(g)⇌CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正) ___v(逆) |
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为___mol/L.