(2014届山东省日照市高三3月模拟考试理综化学试卷)电化学在日常生活中用途广泛,图甲是镁一次氯酸钠燃料电池,电池总反应为:Mg+ClO - +H 2 O=Cl - +Mg(OH) 2 ,图乙是含Cr 2 O 7 2- 的工业废水的处理。下列说法正确的是 A.图甲中发生的还原反应是Mg 2+ +ClO - +H 2 O+2e - =Cl - +Mg(OH) 2 B.图乙中Cr 2 O 7 2- 向惰性电极移动,与该极附近的OH-结合转化成Cr(OH) 3 除去 C.图乙
2019-11-23
| (2014届山东省日照市高三3月模拟考试理综化学试卷) 电化学在日常生活中用途广泛,图甲是镁一次氯酸钠燃料电池,电池总反应为:Mg+ClO - +H 2 O=Cl - +Mg(OH) 2 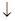 ,图乙是含Cr 2 O 7 2- 的工业废水的处理。下列说法正确的是 ,图乙是含Cr 2 O 7 2- 的工业废水的处理。下列说法正确的是
|
 ,正确;B、电解池中阴离子向阳极移动,所以图乙中Cr 2 O 7 2- 金属铁电极移动,错误;C、图乙电解池阳极反应为Fe—2e‾=Fe 2+ ,阴极反应为2H + +2e‾=H 2 ↑所以若有0.084 g阳极材料参与反应,则阴极产生氢气的体积为:0.084g÷56g/mol×22.4L/mol=0.0336L=33.6ml,错误;D、图甲燃料电池消耗3.6 g镁时,失去的电子式0.3mol,图乙中阳极反应为:Fe—2e‾=Fe 2+ ,根据电子守恒,生成的Fe 2+ 为0.15mol,所以最后生成的Fe(OH) 3 也是0.15mol,质量为16.05g,错误。
,正确;B、电解池中阴离子向阳极移动,所以图乙中Cr 2 O 7 2- 金属铁电极移动,错误;C、图乙电解池阳极反应为Fe—2e‾=Fe 2+ ,阴极反应为2H + +2e‾=H 2 ↑所以若有0.084 g阳极材料参与反应,则阴极产生氢气的体积为:0.084g÷56g/mol×22.4L/mol=0.0336L=33.6ml,错误;D、图甲燃料电池消耗3.6 g镁时,失去的电子式0.3mol,图乙中阳极反应为:Fe—2e‾=Fe 2+ ,根据电子守恒,生成的Fe 2+ 为0.15mol,所以最后生成的Fe(OH) 3 也是0.15mol,质量为16.05g,错误。