砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途.回答下列问题:(1)画出砷的原子结构示意图.(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫.写出发生反应的化学方程式.该反应需要在加压下进行,原因是.(3)已知:As(s)+ 3 2 H2(g)+2O2(g)=H3AsO4(s)△H1H2(g)+ 1 2
2020-02-07
砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途.回答下列问题:
(1)画出砷的原子结构示意图___.
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫.写出发生反应的化学方程式___.该反应需要在加压下进行,原因是___.
(3)已知:As(s)+
H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+
O2(g)=H2O(l)△H2
2As(s)+
O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H=___.
(4)298K时,将20mL 3x mol•L-1 Na3AsO3、20mL 3x mol•L-1 I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-⇌AsO43-(aq)+2I-(aq)+H2O(l).溶液中c(AsO43-)与反应时间(t)的关系如图所示.
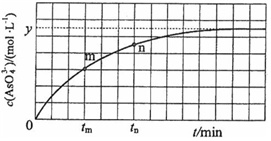
①下列可判断反应达到平衡的是___(填标号).
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.c (AsO43-)/c (AsO33-)不再变化
d.c(I-)=y mol•L-1
②tm时,v正___ v逆(填“大于”“小于”或“等于”).
③tm时v逆___ tn时v逆(填“大于”“小于”或“等于”),理由是___.
④若平衡时溶液的pH=14,则该反应的平衡常数K为___.
(1)画出砷的原子结构示意图___.
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫.写出发生反应的化学方程式___.该反应需要在加压下进行,原因是___.
(3)已知:As(s)+
| 3 |
| 2 |
H2(g)+
| 1 |
| 2 |
2As(s)+
| 5 |
| 2 |
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H=___.
(4)298K时,将20mL 3x mol•L-1 Na3AsO3、20mL 3x mol•L-1 I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-⇌AsO43-(aq)+2I-(aq)+H2O(l).溶液中c(AsO43-)与反应时间(t)的关系如图所示.

①下列可判断反应达到平衡的是___(填标号).
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.c (AsO43-)/c (AsO33-)不再变化
d.c(I-)=y mol•L-1
②tm时,v正___ v逆(填“大于”“小于”或“等于”).
③tm时v逆___ tn时v逆(填“大于”“小于”或“等于”),理由是___.
④若平衡时溶液的pH=14,则该反应的平衡常数K为___.