某实验小组用下列装置进行乙醇催化氧化的实验。 ⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
2019-05-30
| 某实验小组用下列装置进行乙醇催化氧化的实验。 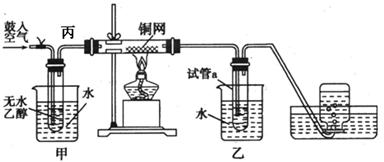 ⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式 、 。 在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是 反应。 ⑵甲和乙两个水浴作用不相同。 甲的作用是 ;乙的作用是 。 ⑶反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是 、 、 。集气瓶中收集到的气体的主要成分是 。 ⑷若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可现在混合液中加入 (填写字母)。 a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳 然后,再通过 (填实验操作名称)即可得到乙醛。 ⑸图中丙处导管应倾斜的原因是 。 ⑹本实验中若不鼓入空气,其他操作不变,乙处试管内也得到了乙醛,则发生的化学方程式为 。 |
 2CuO CH 3 CH 2 OH+CuO
2CuO CH 3 CH 2 OH+CuO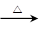 CH 3 CHO+Cu+H 2 O 放热
CH 3 CHO+Cu+H 2 O 放热